|
�`�O���`
�Q�D�f�W�^���o�C�I�}�[�J�[�idBM�j�̒�`
�@�č��H�i���i�ǁiFDA�j�ƍ����q���������̃o�C�I�}�[�J�[���[�L���O�O���[�v�iBiomarkers,
EndpointS, and other Tools, BEST�j�ɂ��ƁC�o�C�I�}�[�J�[�́u����Ȑ����w�I�ߒ��C���a�ߒ��C���͎��ÓI������܂ޔ��I�������͉���ɑ��鐶���w�I�����̎w�W�Ƃ��Čv�������C���m�ɒ�`���ꂽ�����v�ƒ�`�����5�j�B���̃o�C�I�}�[�J�[�ɂ́C����f�Âŗp������o�C�^���T�C����C�����w�����C���t�����C��ᇃ}�[�J�[�Ȃǂ̗Տ������l��摜�f�f�f�[�^���܂܂�C�f�f�C��͊w�┽���C����ɂ̓��j�^�����O�ɗ��p�����5�j�B�ߔN�C�Z���T�[��E�F�A���u���@��ȂǁC�f�W�^���Z�p�̐i���ɂ��C����̊��҃f�[�^��dBM�Ƃ��Ă��ȕւ��p���I�Ɏ擾�ł���悤�ɂȂ�C�l�X�ȗ̈�Ŋ��҂̌��N��Ԃ⎾���i�s�̒�ʕ]�������݂��Ă���i�\1�j4�j�B�����I�ɂ́C�Q�m����̃q�g��`�I�v������C���v���f�[�^�ɉ����CdBM�Ŏ������L�̓���@�\�ُ�┭��������x�Ō��o���邱�ƂŁC�q�ϓI�w�W�����������Ǐ�⌒�N��ԁi�Ⴆ�C�u�ɂ₩��݁C�����̎��ቺ�Ȃǁj�Ɋւ��āC���i�̐V���ȉ��l�������f�[�^���擾�\�ɂȂ�\��������6�j�B
�@�Ȃ��CFDA��dBM���u�f�W�^���w���X�e�N�m���W�[�iDHT�j������W����C����Ȑ����w�I�ߒ��C���a�ߒ��C���͎��ÓI������܂ޔ��I�������͉���ɑ��锽���̎w�W�Ƃ��đ��肳���������͓����Q�v
�ƒ�`���Ă���B���̒�`�Ɂu�����Q�v�Ƃ��Ă���̂́C���l��dBM�����Ƃɕ�����͂��邱�ƂŁC�Ӌ`�̂���ω��𑨂�����\�������邽�߂ł���i�}2�j�B

�@�\1�@�o�C�I�}�[�J�[�̎�ނƁCdBM�̊��p����7�j
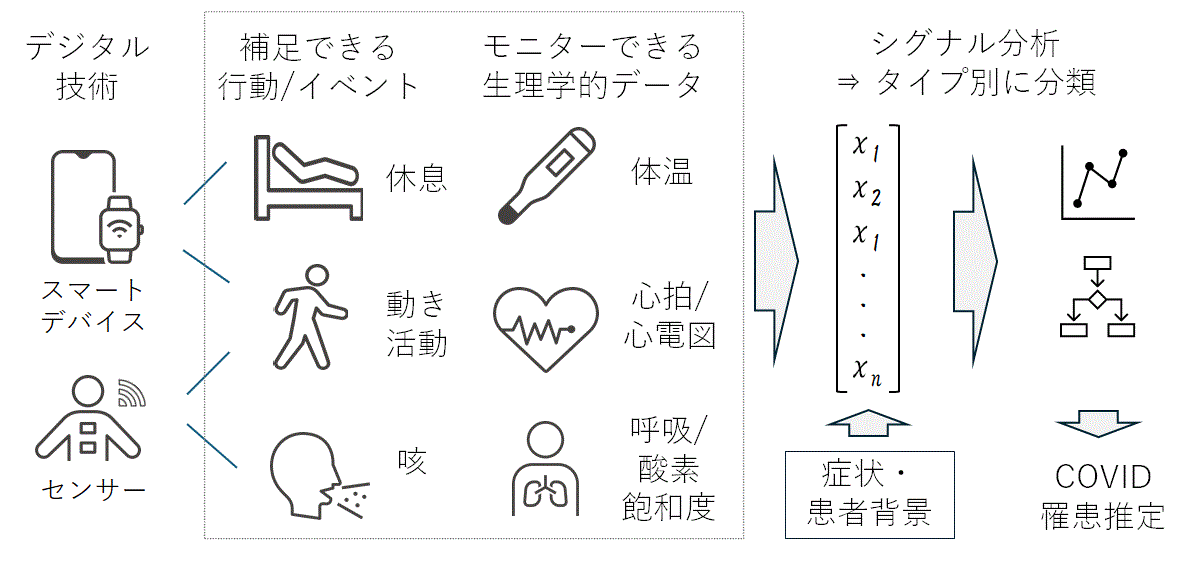
�@�}2�@�u�����Q�v�Ƃ��Ă�dBM�̉\���iCOVID-19�늳���o�A�v���[�`�̎��Ⴉ��j8�j
�`�����`
�S�DdBM�̓����Ɗ��p����
�@�Ǐ�̓����E���Ԃ̕ϓ����傫���_�o�E���_������C��ԂɏǏ���鐇����Q�Ȃǂł́C���퐶���̃f�[�^���d�v�ƂȂ�B�������C�`���I�ȗՏ������ɂ����錟���́C�K�肳�ꂽ���@�ł̎��_�]���ł���C����ɂ�����Ǐ�ω��𑨂��邱�Ƃ�����ł������B
dBM�́C��N�P���C���A���^�C���C�A�����j�^�����O�C�q�ϓI�]���C�����I�ȃf�[�^���W�Ƃ��������_��L���C�����̉ۑ�������ł���\�����߂Ă���B�ȉ��ɁC����܂ŕ��ꂽdBM�̊��p������Љ��B
�y�g�̋@�\�i�^���@�\�E�^���ʁj�z
�@���s���x������̕ω��́C ���퐶���@�\�̎w�W�ƂȂ�B�������p���I�Ƀ��j�^�����O���Ȃ���s���p�^�[���͂��邱�ƂŁC
�����ɂ��������@�\�̕ω��i�x�[�X���C������̉��P�∫���j���]���\�ƂȂ�B��̓I�ɂ́C�X�}�[�g�E�H�b�`��C�̃C���\�[���Ȃǂɑ��������f�o�C�X���g�p���ăf�[�^���擾����B���s�p�^�[���Ȃǂ̉^���@�\�ُ̈�́C���ɐ_�o�����œ����I�ɂ݂��邽�߁C�p�[�L���\���a�C�Ă�C�A���c�n�C�}�[�^�F�m�ǂ⑽�����d���ǂȂǂŊ��p���Ⴊ����Ă���10�j�B�܂��C�Ԏ����x������ΏۂƂ�����V���Տ������ł́C�A�N�`�O���t��ʂ��������ʂ␇���E�o�����Y�����瑪�肳���g�̊����imoderate/vigorous
physical activity:MVPA�j����v�G���h�|�C���g�Ƃ��Đݒ肵�CFDA�Ƃ����ӂ��ĊJ�����i�߂��Ă���11�j�B
�y����̍s���p�^�[���ɒ��ڂ����]���z
�@�A�g�s�[���畆����ΏۂɁC�����r�̗����ɃZ���T�[��t���C�畆��~������i�~�j�j��]���C�x���g�Ƃ��Č��o����dBM���J�����ł���12�j�B���l�ɁC�����P�u�̗Տ������ł́C
�f�W�^���f�o�C�X�ő��肳�ꂽ24���Ԃ�����̊P�u����v�]�����ڂƂ��Ď��{����Ă���13�j�B����ɁC�Z�p�I�ɂ̓E�F�A���u���f�o�C�X���瓾���鉹���i���ʂƃg�[���j�C�����p�^�[���i�������̐S���C�ċz�⓮���j�C���o�p�^�[���i�����̓����⒍���_�j�C�̉���S��������X�g���X���x���������ł���B�����̃f�[�^��dBM�Ƃ��đg�ݍ��킹�ĉ�͂��邱�ƂŁC���a�⎩�ǁC�s����Q�Ȃǂ̐��_�����ŁC���҂̎��Ȑ\���ɗ��邱�ƂȂ��C��Ԃ̈�������P���q�ϓI�ɕ]���\�ƂȂ邾�낤14�j�B
�`�����`
�U�DdBM��Տ������ŃG���h�|�C���g�Ƃ��ėp����v���Z�X
�@���i�J���ɂ�����dBM��p���悤�Ƃ���ꍇ�C���̑Ó�������ѐM�����̊m�ۂ��ۑ�ƂȂ�BClinical
Trials Transformation Initiative �i�ȉ��CCTTI�j�̃K�C�_���X�ɂ��ƁCdBM������v���Z�X�́C�i1�j
�f�o�C�X�̃Z���T�[�Ȃǂ�ʂ��Đ��f�[�^���擾�C�i2�j ���̃f�[�^��]������я������āC��͉\�ȏ����f�[�^�֕ϊ��C�i3�j�����f�[�^�����̓A���S���Y����p���āC�S�̂���Տ��I�ȃA�E�g�J���𐄒肷��Ƃ������ߒ����o��K�v������16�j�B����ɁCdBM�����؎����̎�v�]�����ړ��Ɋ��p����ꍇ�C�Ó�����M������S�ۂ��錟�i�f�o�C�X�̐��m���C���x����ш��萫��ψꐫ��������j�C���̓o���f�[�V�����idBM
�ւ̃f�[�^�ϊ��C����C�]���v���Z�X�̓K�ؐ��̊m�F�j ����їՏ��o���f�[�V�����idBM ��Ώۊ��ґw�ŗ��p���邱�Ƃ̉Ȋw�I�C�Տ��I�Ó����̊m�F�j���K�v�ƂȂ�i�\3�j�B

�@�\3�@dBM�̑Ó����E�M������S�ۂ��邽�߂�3�̃X�e�b�v4�j
�@�܂��C����DS������Q�l�ɂ���ƁCdBM��Տ������̃A�E�g�J���Ƃ��Ċ��p����ꍇ�ɍl�����ׂ��_�Ƃ��āC�udBM�̎g�p������ړI�����O�ɒ�`���邱�Ɓv�C�udBM�̓��e�I�Ó����i�g�̋@�\��Տ���Ԃ𐳊m�ɔ��f���Ă��邩�j�̊m�F�v�C�u�����̕]���X�P�[���Ƃ̑����v����сudBM�̐M�����m�ہi�Č����C�f�f���x��Տ��ω��ւ̔��f�x�Ȃǁj�v���w�E����Ă���4�j�j�B�Տ�������dBM�����p�����������ЂƁC�f�o�C�X�J���̃v���C���[�͈قȂ邱�Ƃ������B�s�̂̃f�o�C�X��p����ꍇ�C�f�[�^�擾������A���S���Y�������J����Ă��Ȃ����Ƃ������C���f����o�[�W�����̃A�b�v�f�[�g�ɂ�萸�x��m�����قȂ�\��������B���̂��߁C�����J���i�K����K���v���������߂Ɍ����I�ɋ��Ƃ��Ă����K�v������B�܂��C�����_�ł͓��{�ł�dBM�̃o���f�[�V������J���ɓ�������PMDA�̑��k�g�͂Ȃ��B���̂��߁C�]���̈��i�J���̑��k�g�����p���đ��k���邱�ƂƂȂ邪�C���ɗՏ��o���f�[�V�����ɂ͐�含�ƃ��\�[�X�ɉ����đ����̕]�����Ԃ�v���邽�߁C�J����������̓����]���ƌv�旧�Ăɉ����āCPMDA�Ƃ̌v��̎��O���ӂ��d�v�ƂȂ邾�낤4�j�B�Ȃ��C���Ăł�dBM�Ɋւ��鑊�k�g�����݂���B��̓I�ɂ́C��ʓI�ȏ����鑊�k�g�iFDA
: Critical Path Innovation Meeting, EMA : Innovation
Task Force Briefing Meeting�j�ɉ����āC�K�����ǂɂ��dBM�̊J�����p�̔F�Ɋւ��鑊�k�g�iFDA
: Drug Dvelopment Tool Qualification Programs,
EMA : Qualification Advice Meeting�j������17-19�j�B���̑��k�g�ł́CdBM���]���̕��@�Ƃ͈قȂ�Տ��I�L�p���̗L���ɉ����āC�Z�p�I�ȓK�ؐ��i���e�I�Ó����C�\���T�O�Ó����C�M�����C�ω��ɑ��銴�x�j�����dBM����莾���̗Տ��]���Ɏg�p���铖�ǔF�ɂ��ċc�_���邱�Ƃ��ł���B
�V�D�Տ��J����dBM�����p���Ă��������ł̉ۑ�ƓW�]
�@dBM�́C������Z�p�v�V���i�ނƊ��҂���Ă���C���i�J���ɂ����ďd�v�Ȗ�����S���Ă������낤�B������AI�Z�p�̐i���ɂ��dBM�̃f�[�^��͂Ɨ\���̍��x���������߁C
�����̌������Ɛ��x�̌��オ���҂����B���̂��߁CdBM���p�̋K����������͕s���ł���C�����K�C�h���C����W���v���Z�X�����߂��邪�C���i�K�ł͋�̓I�v���͌����i�K�ɂ���B��s����FDA�̃K�C�h���C�����Q�l�ɂ���ƁC���҂̃j�[�Y�⎾�����S�C���ÈӋ`�Ȃǂ̐��f�����Ċ��҂̌��N�ɂƂ��ĈӋ`�̂���d�v�ȑ��ʁiMeaningful
Aspect of Health, MAH�j����肵�C�f�W�^���Z�p��p���Ă��̎w�W���J���E�]�����邱�Ƃ��d�v�Ƃ���Ă���B�O�q�̃A�g�s�[���畆���̎�����Q�l�ɂ���ƁC����܂ł̖�Ԃ̑~�j�s���𑪂�r�f�I�B�e�ł́C
�ʏ���ƈقȂ�i�Ɩ����K�v�C�ѕz�͎�菜���C���j�C���҂̓���f���ɂ����B����ɁC���Ƃł̕��͂͑�K�͎����ł͎�Ԃ��p��������ۑ肪�������B���̂��߁CdBM�Ŋ��҂̍s���ڑ��肵�āC�����̏�Ԃ⎡�Ì��ʂ𐳊m�ɕ]�����邱�Ƃ̈Ӌ`���m�F����C�J�����i�߂��Ă���12�j�B
�@����ŁCdBM�ɂ͋Z�p�I�ȉۑ�����݂���B��̓I�ɂ́C�f�[�^�݊�����A���S���Y���̕�Ƃ��������ɑ��������̌������҂����4�j�B�����f�W�^���Z�p�̐i�W�Ɗ��p����̒~�ςɉ����C�K�������ɂ��C�Տ������ɂ�����dBM�̗L�p������荂�܂邾�낤�B

�@�\4�@�C�O��MAH�Ƃ����]������dBM���c�_���ꂽ����
�W�D������
�@�{�e�ł͐����Ƃ̎��_����CDCT�̗v�f�Z�p�ł���dBM�Ƃ����A�v���[�`�ɒ��ڂ��C���̒�`�⊈�p�̕������C����C����ɗՏ��J���ւ̉��p�v���Z�X�ƍ���̓W�]�������BDCT�͐V�^�R���i�E�C���X�̃p���f�~�b�N���ɁC���҂����@�ł��Ȃ��ł��Տ��������p���ł���A�v���[�`�Ƃ��Ē��ڂ��ꂽ�B���݂͊��҂̕��S�y����C�V���ȉ��l�́u�����鉻�v��ړI�Ƃ����������i��2,3�j�C�E�F�A���u���f�o�C�X��\�t�^�Z���T�[�C�����x�E�����Z���T�[�Ȃǂ�p���Ď����̏Ǐ���ԕ]���Ɋ��p����Ă���B�������C�Տ��J���ɂ�����dBM�̊��p�͗��j���C�O������Ȃ��B�ĉ��̎�����Q�l�ɂ���ƁC�����⌒�N�ɂƂ��ĈӋ`�̂���d�v�ȑ��ʁiMAH�j���C���҂̐��������Ȃ���C���̎w�W�𑨂���dBM���J�����邱�Ƃ����߂���BdBM��Տ������̃G���h�|�C���g�ɐݒ肷��ɂ́CdBM�f�[�^�̑Ó����ƐM�����ۏ̃v���Z�X���d�v�ł���C�����̌v�旧�ĂƋK�����ǂƂ̋c�_���s���ł���B���{�ł͌����_��dBM�̃o���f�[�V������J���ɓ�������PMDA�̑��k�g���������߁C�]���̑��k�g�ł�dBM�̓�����o���f�[�V�����v������O�ɍ��ӂ��āC
�i�߂�ׂ��ł���B�܂��CdBM�����i�J���Ɋ��p�����������Ђ�dBM�̊�Z�p������Ђ͕ʂ̃v���C���[�ł��邱�Ƃ��������߁C�A�g���ăj�[�Y�ƋZ�p�����т���c�_���d�v�ƂȂ�B���ҁC�K�����ǁC�f�o�C�X�J����ЂȂǗl�X�ȃX�e�[�N�z���_�[�ő�������c�_���C���Ƃ��邱�ƂŁC�Տ������ɂ�����dBM�̊��p�\���͍��܂�B
�@�Ō�ɁCdBM���܂ރf�W�^���w���X�e�N�m���W�[�S�ʂ̊��p�ŏd�v�Ȃ��Ƃ́C�u�Z�p�I�Ɏ擾�\������v�Ƃ������R�Ŏ��{����̂ł͂Ȃ��C�u���҂⎾���ɂƂ��ĉ����d�v�ŁC�^�Ɏ��ׂ��f�[�^�Ƃ́H�v�Ƀt�H�[�J�X���邱�Ƃł���BdBM�Ȃǂ̐V�Z�p���܂߁C�ړI��ۑ�Ɋ�Â��āgFit
for Purpose�h�C���Ȃ킿�擾���ׂ��f�[�^��K�ȋZ�p�ƈ�v�����C�\�Ȍ��芳�҂̈ӌ��𑁊��Ɏ�����邱�ƂŁC�Ӌ`�̂���dBM�𐢂ɑ���o�����Ƃ��ł��邾�낤�B
���{�e�̑S�Ă̓��e�́u����PHARMSTAGE�v�Q�O�Q�T�N�V����
�{���ł�������������
�@�@����PHARMSTAGE�̃z�[���y�[�W�͂�����
�@�@https://www.gijutu.co.jp/doc/magazine_pharm%20stage.htm
�Q�l����
2�j���� �Տ��]������D�Տ��J���ɂ�����f�W�^���g�����X�t�H�[���[�V�����iDX�j�̌���Ɖ\���i2024�j
�@ https://www.jpma.or.jp/information/evaluation/results/allotment/tcjmdm0000001ecw-att/CL_202405_TF1_DX.pdf
3�j���� �Տ��]������DDCT �ɂ�����f�[�^�̗���Ƃ��̐M�����m�ہi2022�j
�@ https://www.jpma.or.jp/information/evaluation/results/allotment/gbkspa00000017ol-att/DS_202208_DCT_f01.pdf
4�j���D�Տ��]������D���i�J���ɂ�����f�W�^���o�C�I�}�[�J�[�idBM�j�̗����p�Ɨv���i2022�j
�@https://www.jpma.or.jp/information/evaluation/results/allotment/rfcmr0000000216e-att/digital_biomarker_202204.pdf
5�jBiomarkers Definitions
Working Group. Biomarkers and surrogate endpoints
: Preferred definitions and conceptual framework.
Clin Pharmacol Ther. 2001 Mar ; 69 (3) : 89-95
6�j���˖��F�D���i�J���ɂ�����E�F�A���u���f�o�C�X�̊��p�D���j���[�X�i2021�j
�@ https://www.jpma.or.jp/opir/news/063/pdf/pdf-05-01.pdf
7�jVasudevan S et al. Digital
biomarkers : Convergence of digital health technologies
and biomarkers. NPJ Digit Med. 2022 Mar 25 ; 5
(1) : 36
8�jBotonis O et al. Feasibility
of snapshot testing using wearable sensors to
detect cardiorespiratory illness (COVID infection
in India). NPJ Digit Med. 2024 Oct 19 ; 7 (1)
: 289
10�jMasanneck L et al. Evidence
from ClinicalTrials.gov on the growth of Digital
Health Technologies in neurology trials. NPJ Digit
Med. 2023 Feb 10 ; 6 (1) : 23
11�jBellerophon Therapeutics
Press Release. 2022
�@�@https://www.globenewswire.com/news-release/2022/09/27/2523327/0/en/Bellerophon-Announces-FDA-Acceptance-of-Change-to-Ongoing-Phase-3-REBUILD-Study-of-INOpulse-for-Treatment-of-Fibrotic-Interstitial-Lung-Disease.html
12�jCesnakova L et al. A
patient-centred conceptual model of nocturnal
scratch and its impact in atopic dermatitis :
A mixed-methods study supporting the development
of novel digital measurements. Skin Health Dis.
2023 Jul 1 ; 3 (5) : e262
13�j�Q�[�t�@�s�L�T���g�N�G���_������ �\������
CTD2.5 �Տ��Ɋւ��铝���]��
�@�@https://www.pmda.go.jp/drugs/2022/P20210107001/index.html
14�j���]�F �`�a�D�E�F�A���u���f�o�C�X��p�������_�����̕]���D�f�f�Ǝ���
112��13�� �i2024�j
16�jCTTI. Advancing the
Use of Mobile Technologies in Clinical Trials:
Recommendations from the Clinical Trials Transformation
Initiative. Digit Biomark. 2019 Sep-Dec ; 3 (3)
: 145-15
17�jFDA. Critical Path Innovation
Meetings (CPIM)
�@�@https://www.fda.gov/drugs/novel-drug-approvals-fda/critical-path-innovation-meetings-cpim
18�jFDA. Drug Development
Tool (DDT) Qualification Programs
�@�@https://www.fda.gov/drugs/development-approval-process-drugs/drug-development-tool-ddt-qualification-programs
19�jHendrikse MN et al.
Biomarkers in Medicines Development-From Discovery
to Regulatory Qualification and Beyond. Front
Med (Lausanne). 2022 Apr 26 : 9 : 878942
|