|
�P�D�͂��߂�
�@���i����芪�����́C�V��̓o���㔭�i�̎Q���C��×p���i����v�w���E��ʗp���i�ւ̊g��ȂǁC�Љ�̃j�[�Y�ɉ����ē��X�ω����Ă���B���������j�[�Y�ɑΉ����邽�߁C�s���ɂ����Ă��@��������ʒm����ʂ��ēs�x���x�̌��������s���Ă���Ƃ���C�{�e�ł́C�㔭���i�ƈ�ʗp���i�ɂ��Ă��ꂼ��1
���C�ŋ߂̓����ɂ��Ă��Љ�����B
�Q�D�㔭���i�ɂ����鎩��_���ɂ���
�@���i�̕i�����́C���p�҂̌��N�ɒ��ړI�ɉe����^���邱�Ƃɉ����C�����o�ג�~�ɂȂ邱�Ƃɂ��s�ꗬ�ʗʂ��������֘A�i�ڂ̋����s���艻�������N�������Ƃ���C���̉��P�y�ѕi���m�ۂɌ��������g�݂͌����J���ȂɂƂ��čŏd�v�ۑ��1
�ƂȂ��Ă���B�ߔN�C�������ԉB���␇�������܍����̖�蓙�����đ����ɐ��������Ƃɂ��i���m�ۂɑ���M�����h�炢�ł���C����܂ŁC����28
�N�ɂ͌����J���Ȃ̎w���Ɋ�Â���ē_��1�j���C�܂��ߘa3 �N�ɂ͓��{�W�F�l���b�N����ɂ�鎩��I�ȓ_�����s���Ă����B
�������Ȃ���C�ˑR�Ƃ��āC���Ɍ㔭���i�̐����̔��Ǝ҂ɑ���s�������������đ����Ă���C�����J���Ȃ��J�Â����c2�j�ɂ����ẮC�u����_�������Ă���������Ă���̂ł͂Ȃ����v�C�u���܂ł̕��@�ł͈ӎ��I�E���ӎ��Ɋւ�炸�C�B���Ă���E�B��Ă�����̂͌������Ȃ��̂ł͂Ȃ����v���̎w�E���Ȃ���Ă���B�����������Ƃ����܂��C�㔭���i�ւ̐M�����Ɍ����ƊE�S�̂Ƃ��Ď��g��ł��炤�ׂ��C���߂Ă��������̍�������_������{����c�̘A�����ʂ��C�e���Ǝ҂Ɏ��g��ł����������ƂƂ���3�j�B
�@���Y����_���ɂ��Ă͗ߘa6 �N4 ��5 �����瓯�N10 ��31 ���̊ԂɎ��{���ꂽ�B�_���Ώۂ͌㔭���i�̐����̔����F��L����S172
�ЁC�_����@�́C���C���o�C���C���ɂ�鏳�F���Ǝ菇�����̓ˍ��ɉ����C�e��u���ʁv�Ɓu�������ԁv�̘������Ȃ����C�����E�������ɏ]�����Ă���]�ƈ����ւ̃q�A�����O�����{���Ē������B�܂��C�����p�����߂邽�߁C���v�ʕ��̐ݒu�E���m�����߂��B�X�ɁC�s���Ƃ��ẮC����_����ɓs���{���ɂ�閳�ʍ������������������Ƃ����O�Ɏ��m���邱�Ƃɂ���������S�ۂ���ƂƂ��ɁC���̗��������ɍۂ��ẮC�s���{���̏ɉ����Ɨ��s���@�l���i��Ë@�푍���@�\�����{�E�x���ł���̐��Ƃ��邱�ƂƂ��Ă���B
�@�܂��C����_����̖葱���ɂ��ẮC�ߘa6 �N10 ��30 ���t���Ō����J���Ȃ���ʒm4�j�y�ю����A��5�j�i�ȉ��u�_����葱�ʒm���v�Ƃ����B�j�o���Ă���C���Y����_���̑ΏۂƂȂ��Ă��鎖�Ǝ҂ɂ����ẮC�_����葱�ʒm����葱���t���[�i�}1�j���悭�m�F�̏�C�ߘa7
�N4 ��30 ���܂łɓK�Ȗ葱�����s�����ƂƂ��Ă���B
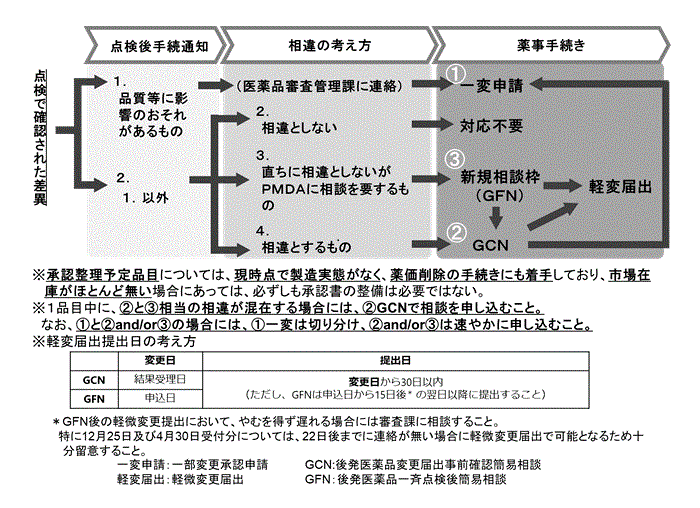
�@�}1�@�Ή��葱���̃t���[
�R�D�X�C�b�`OTC ����ʂ����Z���t���f�B�P�[�V�����̐��i
�@����̌��N�͂ł�����莩��ŊǗ�����u�Z���t�P�A�E�Z���t���f�B�P�[�V�����v�̐��i�́C�����J���ȂɂƂ��ďd�v�Ȏg���̈�ł���C���i�R���Ǘ��ۂł́C���̈ꏕ�ƂȂ�u�X�C�b�`OTC
���v�ɂ��Ă����g��ł���B�u�X�C�b�`OTC ���i�v�Ƃ́C��×p���i�Ƃ��ď��F����Ă�����i�̂����C���̌��\�E���ʋy�їp�@�E�p�ʂ͈͓̔��ŗv�w���E��ʗp���i�Ƃ��ď��F�������i�����C�ߘa6
�N3 ���C�K�����v���i��c���N�E��ÁE��샏�[�L���O�E�O���[�v�ɂ����āC�����J���ȁC���i��Ë@�푍���@�\�y�ѓ��{OTC
���i�����Ȃ�X�C�b�`OTC WG ��V�݂��C�X�C�b�`OTC ���i�̐R���ɕK�v�ƂȂ�\�������̌����������܂߁C�v���ȃX�C�b�`���Ɍ�������g�����c�E���{���Ă����|����Ă����B�{�e�ł́C�����_�܂ł̐i���ɂ��Ă��Љ�����B
�@�]�O�ł́C�V�K�ɃX�C�b�`OTC ���i�ƂȂ鐬���̏��F�\���ɍۂ��āC���̗Տ��������ʂ̓Y�t��v�����Ă������C�X�C�b�`OTC
WG �ɂ����āC�R���ɂ�����Տ��������ʂ̊��p�ɂ��ĉ��߂Đ��������Ƃ���C�ȉ��̏ł������i�ΏہF�v�w�����i�̋敪���ݒ肳�ꂽ����26
�N6 ���ȍ~�ɏ��F�����V�K�X�C�b�`OTC���i18 �i�ځj�B
�@�@�@ ��×p���i�̗Տ��������ʂ̍ĉ�͂�Y�t��������i8
�i�ځj
�@�@�A ��×p���i�̗Տ��������ʂ����̂܂ܓY�t��������i10 �i�ځj
�@�@�B ��×p���i�̗Տ��������ʈȊO�̗Տ��������ʂ�Y�t��������i0 �i�ځj
�@�@�̃P�[�X�ɂ��čX�ɏڍׂ��m�F����ƁC��×p���i�̗Տ������Ɂu�X�C�b�`OTC
���i���ΏۂƂ��Ȃ��d�Ǔx���̃f�[�^�v���܂܂�Ă�����C�u�X�C�b�`OTC ���i�Ƃ��ċK�肵�悤�Ƃ���\���p�@�E�p�ʈȊO�̃f�[�^�v���܂܂�Ă����肵�����߁C�X�C�b�`OTC
���i���ΏۂƂ���g�p�W�c�Ɍ��肵�ėL��������������K�v�����������߂Ɏ��{���ꂽ���̂ł������B�܂��C�A�̃P�[�X�ɂ��Ă��C���̐R���ɂ����āC�X�C�b�`OTC
���i�Ƃ��Ďg�p�����ꍇ�ɑz�肳���V���Ȓm���͔F�߂��Ȃ������B
�@��L�̌��ʋy�сC�X�C�b�`OTC ���i�����́C��×p���i�Ƃ��Ē��N�g�p����C�K�Ɏg�p����C���̗L�����y�ш��S���͏\���Ɋm�ۂ���邱�Ƃ����Ɋm�F����Ă�����̂ł��邱�Ƃ܂��C���ʁC�u�ȉ��̇@�B���͇A�B�����V�K�X�C�b�`OTC
���i�̐\���ɍۂ��Ă͗Տ��������ʂ̒�o�͕K�{�ł͂Ȃ��v�Ɛ������C�ߘa6 �N10 ���C�W�ʒm���̉������s�����i�u�u���i�̏��F�\���ɂ��āv�̈ꕔ�����ɂ��āv�i�ߘa6
�N10 ��9 ���t�����1009 ��1 ���j�j�B
�@�@�@ ���ƂȂ��×p���i�Ɛ����w�I���������m�F����Ă���ꍇ
�@�@�A ���ƂȂ��×p���i�Ɠ��ꐬ���y�ѕ��ʕ��тɍ܌`�ł���ꍇ
�@�@�B ���\���͌��ʂ����ƂȂ��×p���i�̏��F�����͈͓̔��ł���C�e�X�̌��\���͌��ʂɂ��ėp�@�y�їp�ʂ����ƂȂ��×p���i�̏��F�����Ɠ���ł���ꍇ
�@�������C�\���ɍۂ��ēY�t���ׂ������ɂ��Ă͏�L�̂Ƃ���ꕔ�ύX�������̂́C�X�C�b�`���͂��Ȃ킿��t�ɂ��f�@��������Ȃ��Ȃ邱�Ƃ��Ӗ����邽�߁C�]�O��菳�F�R���ɂ����ďd�����Ă���C�@��Ǔ��ł̍w�����ɖ�t������v�҂֍s���X�C�b�`OTC
���i�̊m�F�����E�w�����e�̏[�����C�A�K���g�p���m�ۂ��邽�߂̕���̓K�ؐ��̊ϓ_�C���ɂ��ẮC���������C�d�_�I�ɍs���Ă����ׂ����Ƃ������Ċm�F���ꂽ�B
�@�����J���Ȃł́C�Z���t���f�B�P�[�V�����̐��i�Ɍ����C����28 �N4 �����u��×p����v�w���E��ʗp�ւ̓]�p�Ɋւ���]��������c�v�i�ȉ��C�u������c�v�Ƃ����B�j���J�Â��Ă���C�e�X�e�[�N�z���_�[����̑��l�Ȉӌ��܂��C�X�C�b�`���ɌW��ۑ�₻�̉�����ɂ��Č��J�ŋc�_���s���Ă������C���ʁC�K�����v���{�v��i�ߘa6
�N6 ��21 ���t�c����j�ɂ����čX�Ȃ�X�C�b�`�����i�ɌW��V���ȖڕW���ݒ肳�ꂽ���Ƃ܂��C�ߘa6
�N10 ���C����̌�����c�̐i�ߕ���ύX�����B��ȕύX�_�͈ȉ��̂Ƃ���B
�@�@�@ ����܂ŁC������c��ɍs���Ă����p�u���b�N�R�����g�Ƃ͕ʂɁC�v�]�҈ȊO�̃j�[�Y����\�ߍL�����W���邱�Ƃ�ړI�Ƃ��āC�����Ɋւ��邲�ӌ���W��]��������c�O�Ɏ��{����B
�@�@�A �����̃X�C�b�`OTC ���ɌW�錩���ɂ��āC����܂ł͊W����w��E���݂̂��璮�悵�Ă������C����͋ƊE��������悷�邱�ƂƂ���B
�@�@�B ��Ƃ��v�]���͐\�����������ł����āC���Y��Ƃ���]����ꍇ�ɂ́C��Ƃ̂��ӌ���ǂ��f�����߁C������c�ւ̏o�Ȗ��̓q�A�����N���s�����Ƃ���B
�@�@�C �u�Ƃ�܂Ƃ߁E���\�v�܂ł̕]��������c�̉������Ƃ���1 ��Ƃ���B
�@���̕ύX��ʂ��āC����܂ł������[���c�_���v���Ȍ��ʂƂ�܂Ƃ߂�ڎw���Ă��������B
�@�����J���ȂƂ��ẮC��L�ɗ��܂邱�ƂȂ��C�X�Ȃ�X�C�b�`���̑��i�C�X�ɂ͂��̐�̃Z���t�P�A�E�Z���t���f�B�P�[�V�����̐��i�Ɍ����āC����������g��i�߂ĎQ�肽���B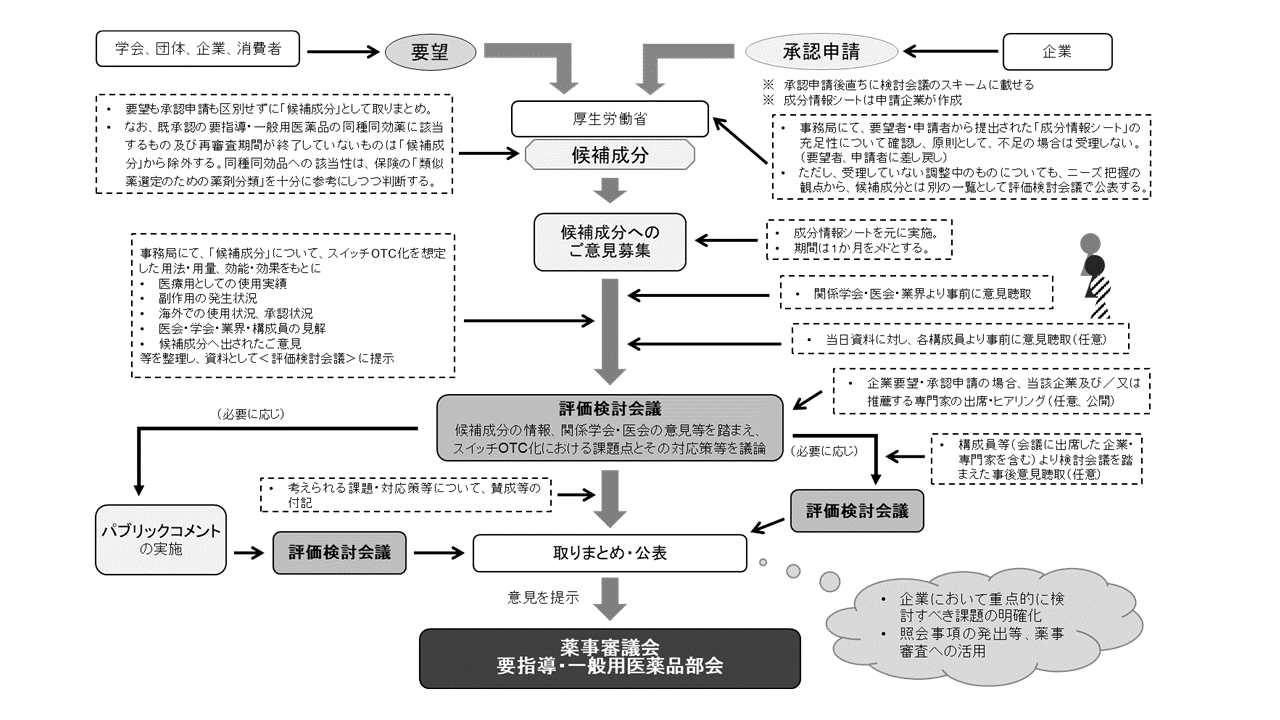
�@�}�Q�@������c�ɂ����錟���̐i�ߕ�
�@�������́u����PHARMSTAGE�v�Q�O�Q�T�N�Q�����@�{���ł�������������
�@�@����PHARMSTAGE�̃z�[���y�[�W�͂�����
�@�@https://www.gijutu.co.jp/doc/magazine_pharm%20stage.htm
�Q�l����
1�j���i�̐����̔����F���Ɛ������Ԃ̐������ɌW��_���̎��{�ɂ���
�@�i����28 �N1 ��19 ���t���R���� 0119 �� 1 ���C�����J���Ȉ��E�����q���ǐR���Ǘ��ے��ʒm�j
2�j��11 ���×p���i�̈���m�ۍ�Ɋւ���W�҉�c
https://www.mhlw.go.jp/stf/newpage_38628.html
3�j�㔭���i�̐����̔����F���Ɛ������@�y�ю������@�̎��Ԃ̐������ɌW��_���̎��{�ɂ���
�@�i�ߘa6 �N4 ��5 ���t���㐭�Y��锭0405 ��1 ���E����R��0405 ��8 ���E���Ė���0405��1
���C
�@ �����J���Ȉ㐭�Lj��Y�ƐU���E��Ï����ہC
�@ ���Lj��i�R���Ǘ��ے��y�ъĎ��w���E�����ے��A���ʒm�j
4�j�㔭���i�̐����̔����F���Ɛ������@�y�ю������@�̎��Ԃ̐������ɌW��_����̎葱���ɂ���
�@�i�ߘa6 �N10 ��30 ���t������R��1030 ��5 ���C�����J���Ȉ��Lj��i�R���Ǘ��ے��y�ʒm�j
5�j�㔭���i�̐����̔����F���Ɛ������@�y�ю������@�̎��Ԃ̐������ɌW��_���ɂ����鑊��̍l�����ɂ���
�@�i�ߘa6 �N10 ��30 ���t�������J���Ȉ��Lj��i�R���Ǘ��ۋy�ъĎ��w���E�����ۘA�������A���j
|