|
�P�D�͂��߂�
�@���i�J���́C�ᕪ�q����o�C�I�ւƎ��Ã��_���e�B�̕ϑJ���i��ł���1�j�C����e�Ђ͍R�̈��̂悤�ȑ����̎����։��p���\�ȐV�K���_���e�B���i�����o���ׂ��C���̂�������Ă���ł���BEvaluate
�Ђɂ�鐢�E�̈��i�J���p�C�v���C���i�ڐ����W�v�����\1 �̌��ʂł́C�V�K���_���e�B���i��Phase
�U�ȑO�ɑ������݂��C�i�ڐ��ł͍R�̈��ɔ��鐨���ł���B
�@����ɁC���Y�Ɛ������ɂ����{�̑�萻����9 �Ђ̊O�������i�̒���2�j�ɂ��ƁCPreclinical�i��Տ��j�i�K�̕i�ڂ��ł������C�V�K���_���e�B���i��]������@����������Ă�����̂Ɛ��@�����B�܂��C���{���n��̉��l�ő剻������iJVO�j�̌�����3�j�֎Q���������36
��73 ���̉��A���P�[�g�ɂ��C���i�̍ŏI�ڕW��`����TPP�itarget product
profile�j�̍쐬�����͔�Տ��i�K�Ƃ̉�85�����߂Ă���C�e�Ђ͌����J���̑�������TPP
�ݒ�ɂ������I�Ȍ����J����ڎw���ƂƂ��ɁC�A�Z�b�g�̓��o���⌤���J���X�e�[�W�A�b�v��Go/No-Go
���f�̂��߂Ɏs��\���┄��\���C�Ђ��Ă͎��Ɛ��]�������{���Ă���\��������B
�@�{�e�ł͈��i�����J���̑����i�K����쐬����Ă���TPP �ɒ��ڂ��CTPP �Őݒ肵���A�Z�b�g�̃|�e���V������10
�N��̎s��\���┄��\���ɂǂ̂悤�ɔ��f���C����ɑk���ăA�Z�b�g�̉��l�ő剻�Ɍ�����TPP���ǂ�����E�^�p���ׂ����C�s��\���C����\������ю��Ɛ��]�����s���r�W�l�X�]���S���҂̖ڐ��ʼn������B
�\1�@�V�K���_���e�B�ʂ̏�s�i�ƊJ���i�iPhase1
�ȍ~�j
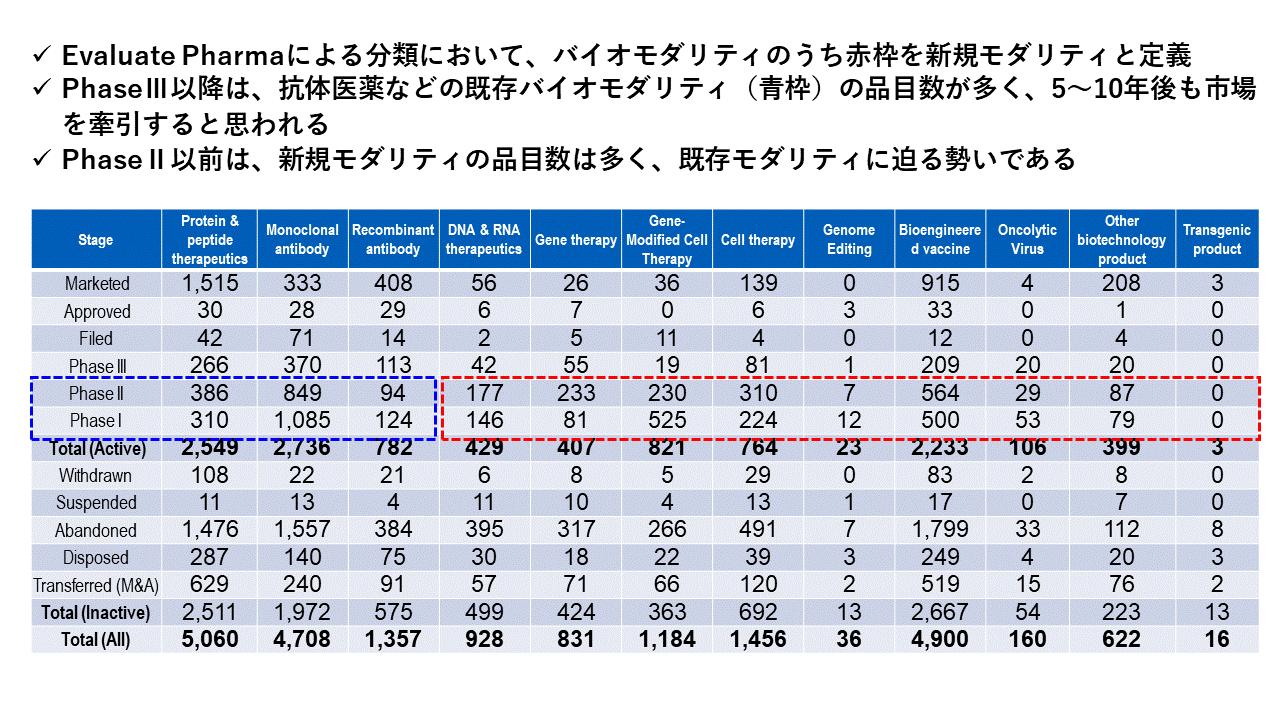
�o�T�FEvaluate Pharma 2024/01/07
Other biotechnology product�F�v���o�C�I�e�B�N�X�A�o�N�e���I�t�@�[�W�A�y�f�A�g�������o���A�V�R�G�L�X��
�Q�DTPP�itarget product profile�j�Ƃ�
2.1 TPP �쐬�̈Ӌ`
�@TPP �́C���i�J���v���Z�X�����������邽�߂�FDA�iFood
and Drug Administration: �A�����J�H�i���i�ǁj�����������v��c�[���ł���4�j�B���i�J����Ƃ��ڕW�Ƃ��鐻�i���\���܂Ƃ߂��C������v�}�̂悤�Ȃ��̂ł���CFDA
�Ƃ̋c�_�ɗp�����Ă��鑼�CWHO ��䂪���ł�AMED�iJapan Agency for
MedicalResearch and Development�F���{��Ì����J���@�\�j�ł��̗p����C���i�����J����Ƃ֍L�����y���Ă���B
�@TPP �쐬�̈Ӌ`�́C���ǂƂ̑Θb�ł̊��p�݂̂Ȃ炸�C���i�����J����Ɠ��ł̕��剡�f�I�ȍŏI�ڕW�Ƃ��Ă̋��L�C�܂������Ƃ�s�꒲���ɂ������t�⊳�҂ւ̐����ȂǁC����ɂ킽�芈�p����Ă���C�{�e�̃e�[�}�ł���s��\���C����\������ю��Ɛ��]���ɂ����Ă��d�v�Ȗ�����L���Ă���B
2.2�@TPP �̍��ڂƋL�ړ��e��3 �̃|�C���g
�@��ʓI��TPP �̍��ڂƋL�ړ��e�C�܂��M�҂����ɏd�v�����Ă���3
�̃|�C���g��\2 �ɋL�ڂ����B
�\2�@TPP �̍��ځE���e�Əd�v��3 �̃|�C���g
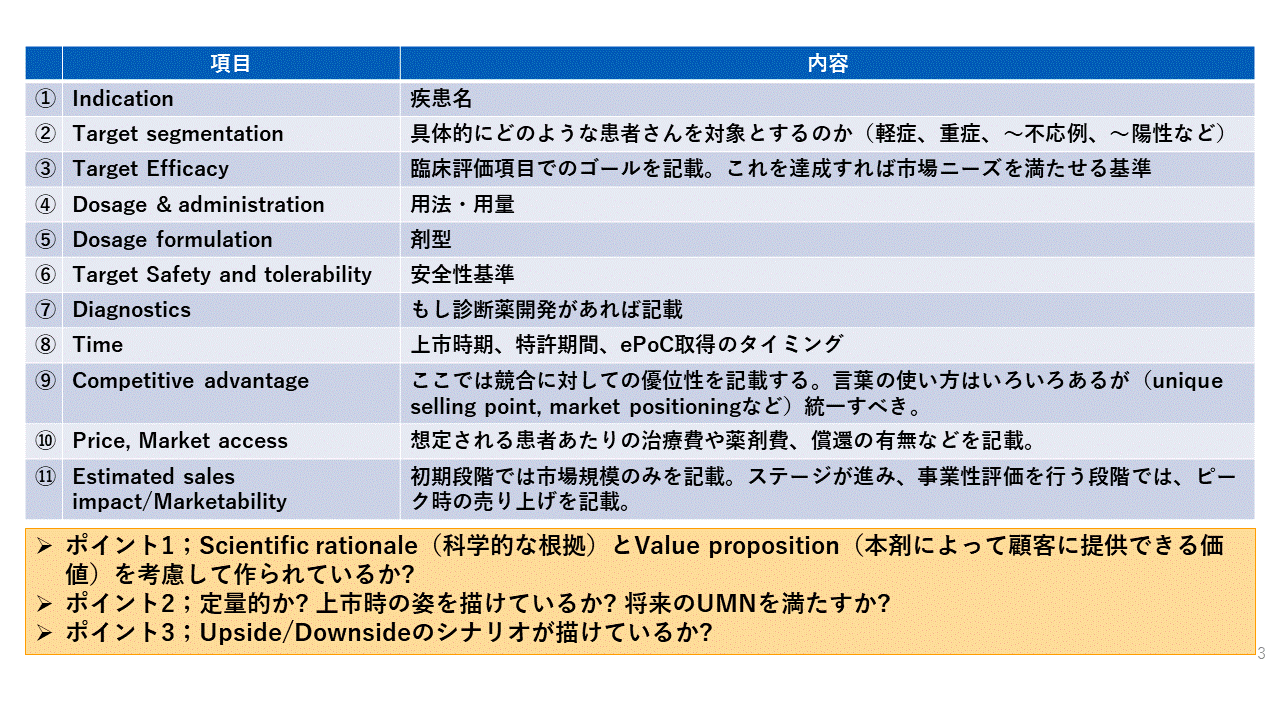
�i1�j Scientific rationale�i
�Ȋw�I�ȍ����j ��Valueproposition�i�{�܂ɂ���Čڋq�ɒł��鉿�l�j���l�����č���Ă��邩�H
�@�O�͂ŏq�ׂ��ߔN�������Ă���V�K���_���e�B���i�ɂ����ẮC�^�[�Q�b�g�ƂȂ鎾���͓�a������E�Z�O�����g�ł��邱�Ƃ������C�Ó��ȕ]���n���Ȃ��Ȃǔ�Տ����ʂ��q�g�֊O�}���邱�Ƃ�����ȏꍇ�������B���̂悤�ȏꍇ��TPP
�ł́C�����ɂ�����UMN�i�A�����b�g�E���f�B�J���E�j�[�Y�j�ɉ����闝�z�I�Ȏp�ɂ�����Ȃ����C��X�̃f�[�^�̐ςݏd�˂ƃA�J�f�~�A�⑼�Ў��ጤ���Ȃǂ�Scientific
rationale �Ɋ�Â��Đ����ł���ӏ��ƁC�����̂Ȃ��ӏ���]���S���҂͗������Ă����K�v������BScientific
rationale �̂Ȃ������J���i�ɂ�����r�W�l�X��ł̖��͂��������Ƃ��Ă��C�ň��̏ꍇ�͗Տ����������s���}�C�i�X�̉��l�������c�邱�ƂɂȂ�BTPP
�ōł����ӂ��ׂ��|�C���g�ł��낤�B
�@�܂��CTPP �ɋL�ڂ̐����C�Ⴆ�Ό��ʂ̓x�����╛��p�̕p�x�Ȃǂ́C��t����ۂɓ��^���ꂽ���҂łȂ��ƗՏ��I�ȈӋ`������Ȃ��ꍇ�������B�A�g�s�[���畆���́u���ǁv�Ɓu����݁v�̂悤�ɁC��t�̐f�@���ɂ��Ǐ�Ƃ��Č���Ă���u���ǁv�ƁC�f�@���Ɍ���Ă��Ȃ��u����݁v�Ƃł́C���Â�������t���̃j�[�Y�ƁC���Â��Ă��炢�������ґ��̃j�[�Y�ɃM���b�v�������邱�Ƃ����邾�낤�BTPP
�ɋL�ڂ��ꂽ���ʁC���S���◘���ɂ��C��t��Ō�t�ɂƂ��Đf�@��Ō�̏�ʂłǂ̂悤�ȏ����Ɍq����̂��C���҂₻�̉Ƒ��C���҂��ǂ̂悤�ȏ�ʂŏΊ�ɂȂ��̂������炩�ɂȂ�C���剡�f�I�Ȍ����J���`�[�������o�[�̃��`�x�[�V�����ێ��⌋���ɂȂ��邾���łȂ��C�ӎv������s���o�c��C�܂������Ƃɂ����Ă����i�̉��l�𗝉����Ă��炤���Ƃ��\�ƂȂ�BTPP
��B�����邽�߂ɂ́C����N���蓾��l�X�ȍ���𒅎��ɏ��z���Ă����K�v�����邽�߁CTPP ��P�Ȃ�|���������́u�G�ɕ`�����݁v�ɂ��Ȃ����߂ɂ�Value
proposition �͏d�v�ȃ|�C���g�ł���B
�i2�j ��ʓI���H��s���̎p��`���Ă��邩�H������UMN
�������H
�@TPP �̋L�ړ��e����ʓI�C����s���̎p�������Ă��Ȃ���CValue
proposition �⋣���Ƃ̍��ʉ������������Ȃ����肩�C�`�[���c�_��s�꒲���Ȃǂ�������i�]��������ƂȂ�C
No Go ���f��摗�肵�Ė��ʂȓ������s�����Ƃɂ��q����B
�@�����i�K�ł̋������́C���J��������ȂǂɌ���ꑶ�݂���s���ȏꍇ���������߁C���݂�UMN
������ō쐬���ꂽTPP �ł����Ă����ɂȂ�Ȃ������m��Ȃ��B�Ƃ��낪���l�̋����̑��݂����炩�ɂȂ�ƁC���ʏd����TPP
�Ō����J�����}���̂��C���ʂƈ��S���̃o�����X���d������TPP ��ڎw���̂��C�X�ɂ͓��^�ʁC���^�p�x�C���^�܌^����уf�o�C�X�ȂǗ����ʂɂ����Ă������x�̍���TPP
��ڎw���̂��C�Y�ނ��ƂɂȂ�ł��낤�B���̂悤�ȏꍇ�ł��C�܂���Scientificrationale
�Ɋ�Â����l�@���d�v�ł���C���Y�A�Z�b�g�̗L�������̖�܃N���X�ɂ����āC��荂���L��������S�������҂ł��Ȃ��̂ł���C�����̗����≿�i�����̂��߂̏������K�v�ɂȂ�ł��낤�B���Ȃ킿�C���Y�A�Z�b�g���ǂ̂悤�Ȋ��҂̂ǂ̂悤��UMN
�������ƂɂȂ�̂��H���ꂪ�B�����ꂽ��i�����j�ɂ͂ǂ̂悤��UMN ���V���ɔ���������̂��H���Ȃ��Ƃ����̏�����UMN
�����悤��TPP �����炩���ߐݒ肷�邱�Ƃ��̗v�Ǝv����B�Ⴆ�C�����߃��E�}�`�̐������s��ɂ����ẮC���^�Ԋu�����̒�����p�^���q�̊J�������ɉ����āC�o�C�A�����v���t�B���h�V�����W���I�[�g�C���W�F�N�^�[�Ƃ������f�o�C�X�̊J�������������ɋN����C�X�Ɍ��݂͉��i�j�[�Y�����������o�C�I�V�~���[�Ƃ̋������N�����Ă���B�����̏����ڂŌ��Ȃ���TPP
�̉��肵�Ă����̂ł́C���̂悤�ȊJ�������ɏ��x��Ă��܂��ł��낤�B
�i3�jUpside/Downside �̃V�i���I���`���Ă��邩�H
�@�O�q�̒ʂ�C�s�m�����̍��������i�K�ł́C���ʂ����Ȃ������\���͍���ł���B�n�[�h���̒ႢTPP
��ڎw���Ɖ��l�̒Ⴂ�A�Z�b�g�Ƃ��ē����Ώۂ���O���ꂽ��C���ǂ����߂��ɍ��v�����J�����~�ɒǂ����܂ꂽ��C��s�ł����Ƃ��Ă������D�ʐ���UMN
�����Ȃ��A�Z�b�g�ɂȂ�\��������B����C�n�[�h���̍���TPP ��ݒ肷��ƃ`�[���̉ۑ�B��������ɂȂ��ă����o�[�̃��`�x�[�V�����ቺ�������C�v��x�����s�ł��Ȃ����X�N�����܂�B���̂悤�ȋ@�����X�N��������邽�߂ɁCFDA
���������Ă���悤�ɏ��F���x���iMinimum�jTPP �ƁC�ڎw���ׂ����x���iPreferred�jTPP
�ɕ�����C�������͂��̊ԂɌ����I�ȒB���\�ȃ��x���iRealistic�jTPP �������ĉ^�p���邱�Ƃ��l������B����烌�x���̈قȂ�TPP
�ł̎s��\���┄��\�����s�����ƂŁC�Г��ł̗D��x�ݒ�C���\�[�X�z���̌���C�����]���Ȃǂ̈ӎv���莞�̋c�_�ɂ��L���Ɋ��p�ł���ł��낤�B
�@�ŏI�ڕW�C���Ȃ킿���҂ɓ͂����ۂ̉��l�������C���Ȃ��ׂ����Ƃɒ��肷�邱�Ƃ�TPP �쐬�E�^�p�̖{��������B�ڎw���ׂ��iPreferred�jTPP
��B�����邽�߂̉ۑ�Ƀ`�������W���Ȃ���C���x��������TPP �͖{���̐��i���l�����������ƂȂ��Ă��܂����Ƃɂ͗��ӂ��ׂ��ł��낤�B
�@�������́u����PHARMSTAGE�v�Q�O�Q�T�N�Q�����@�{���ł�������������
�@�@����PHARMSTAGE�̃z�[���y�[�W�͂�����
�@�@https://www.gijutu.co.jp/doc/magazine_pharm%20stage.htm
�Q�l����
1�j�w��������E��ՋZ�p�̓����ƓW�]�C���i���ׂ������J���헪�x���������J���@�l�Ȋw�Z�p�U���@�\
�����J���헪�Z���^�[�C
�@https://www.jst.go.jp/crds/pdf/2018/WR/CRDS-FY2018-WR-12.pdf
2�j���{�̑�萻���Ƃ̃p�C�v���C������ �`���ЃI���W���ƊO�������̔�r�`�C���Y�Ɛ�����No.
69�C2023 �N07 �����s�C
�@https://www.jpma.or.jp/opir/news/069/07.html
3�j���{���n��̉��l�ő剻������iJVO�jTPP
Workshop, 2019 �N6��11 ��
4�jFDA : Draft Guidance
for Industry and Review Staff on Target Product
Profile - A Strategic Development Process Tool
�@https://www.federalregister.gov/documents/2007/03/30/E7-5949/draft-guidance-for-industry-and-review-staff-on-target-product-profile-a-strategic-development
|