|
1.はじめに
日本の医薬品の薬価制度は根本的な考え方を受け継ぎながらも新薬の薬価算定時の加算の見直し,再算定など上市後の薬価改定ルールの変更,費用対効果評価の導入などこの10
年間でも変化を遂げてきた。その中で日本での医療費抑制へのプレッシャーとイノベーションの評価のバランスに対する考え方は複雑化してきている。
日本では,以前から海外で承認されている医薬品が開発の遅れなどから日本で使用できない状態にある「ドラッグ・ラグ」については議論がされている。例えば,薬価上での措置として革新的な新薬の創出を加速させることを目的として,厚生労働省から開発要請・公募された品目等の開発に取り組んでいる製薬企業が製造販売する新薬(後発医薬品が上市されていないもの)に対して,市場実勢価格に基づく薬価の引下げを猶予する制度「新薬創出加算」や未承認薬・適応外薬の開発促進に資することを目的とした「医療上必要性の高い未承認薬・適応外薬検討会議」が挙げられる1)。さらに,日本での医薬品の開発や上市を促すため,薬価上のインセンティブとして先駆け加算や迅速導入加算などが近年導入されている。さらに,昨今では海外では開発されているが日本で開発されない「ドラッグ・ロス」というキーワードもセットで言及されるように,未だに日本と海外の医薬品の状況に隔たりがあると考えられる。その状況にはそれぞれの国の制度の相違も1
つの要因であると考える。日本では,薬事承認された医療用医薬品は一部の例外(予防に用いられるものやワクチンなど)を除いては保険償還されているが,海外では医療用医薬品の中でも,保険償還されないものや疾患領域によって保険償還率が異なるものなど,全ての医療用医薬品が一様に使用できる状況ではない。また,ヨーロッパでは条件付き保険償還(Market
entry agreement)も医療技術評価とともに導入されている。医療技術評価についても,日本では薬価の改定に用いられているが,海外では保険償還の可否や保険償還率に直接影響を与えている。
一方,海外と同様に日本でもこの数年間非常に高額な薬剤が発売され,海外での薬価が高い製品では日本での発売前に大きな話題になっていたこともあった。
例えば,キムリア(2019 年5 月収載:3349 万円)やゾルゲンスマ(2020 年3 月収載:1
億6707 万7222 円)を始めとした再生医療等製品や年間の薬剤費が298 万円にのぼり,長期での治療が必要な「アルツハイマー病による軽度認知障害(Mild
Cognitive Impairment:MCI)」と「アルツハイマー病による軽度の認知症」の適応で2023
年12 月に薬価収載され,現在費用対効果評価を実施中のレカネマブなどが挙げられる。これらの薬剤はその革新性から治療上の大きな恩恵をもたらすと考えられる半面,医療費や財政に与える影響も大きいと考えられ,業界以外のメディアでも取り上げられていた。
2.現行の薬価制度および医療技術評価の現状
日本の現行の薬価算定方式は主に類似薬効比較方式と原価計算方式である。前者は市場に「類似薬」と見なされる医薬品が存在する場合,その類似薬の薬価に基づき,新製品の薬価が算定される。「
類似薬」を定義する基準は,「効能又は効果」「薬理作用」「組成及び化学構造式」「投与形態,剤形区分,剤形及び用法」であり,基本的にはこれらの要素が新しい医薬品と類似しているものをベースに薬価が算定される。後者は,市場に「類似薬」と見なされる薬剤がないため,当該の新製品に関わる費用(薬価算定単位あたりの製造(輸入)原価に販売費及び一般管理費,営業利益,流通経費,消費税を加えた額を薬価とする。)を積み上げて薬価を算定する方式である。その上で5%から最大で120%の薬剤の算定額への加算(市場性加算・有用性加算・特定用途加算・小児加算・先駆加算・迅速導入加算)を加味したうえで製品の薬価が決定される。原価計算方式では,原価に対する不透明性が問題されており,原価開示度に対する係数などが設定されている。そのため,加算自体が認められても多くの場合では原価の開示度が低いとされるケースが多く,認められた加算率よりも低い加算となるケースが多い。
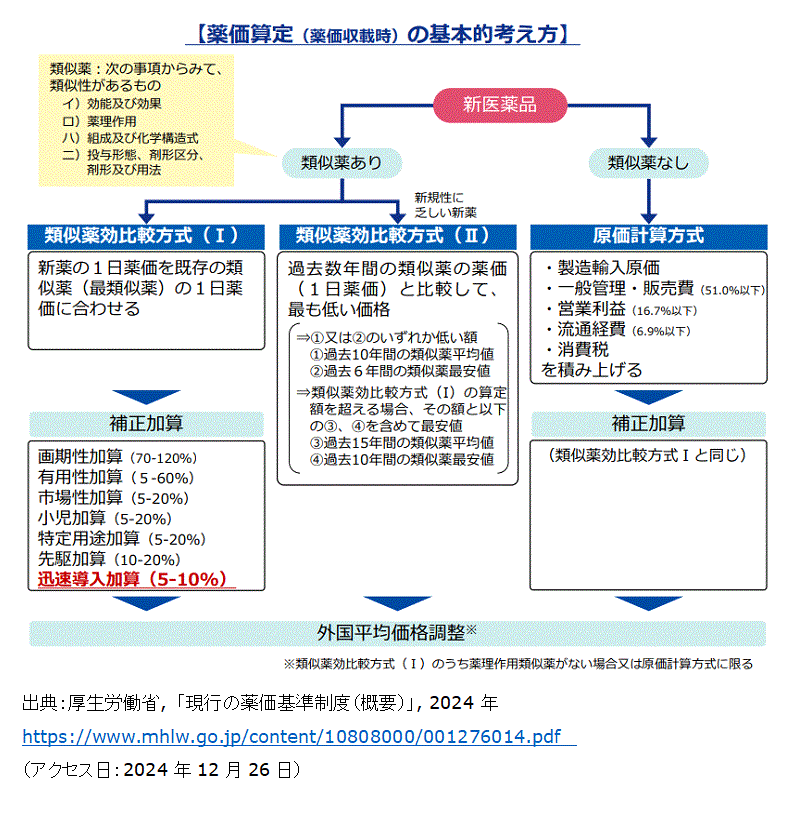
図1 新医薬品の薬価算定方式
3.過去10 年間で変更となったルール・制度
薬価は薬価算定時とその後の薬価改定時に変動する。薬価算定時には,前述の通り主に2
つの算定方式により薬価が算定される。その際,加算が加味されるが,その中でも最近10 年間にイノベーションに関連して変更されていたのが2014
年に導入の「先駆加算」および2024 年に導入の「迅速導入加算」である。これらの加算は,2014
年に「世界に先駆けてわが国で薬事承認を取得した革新的な医薬品」を経済的に評価するもので,14
年度の薬価制度改革で「先駆導入加算」が導入され,その後厚生労働省は「先駆け審査指定制度」を制定した。その後16
年度の薬価改定で,名称を先駆け審査指定制度加算,2022 年に先駆加算に変更した2)。当時の加算要件には,画期性加算または有用性加算(I)の適応を受けるものという条件があったが,現在は,先駆け審査指定制度で指定されているもののうち,日本で先駆けて承認を受けたものとなっている。しかしながら,実際には先駆加算を適用される製品は該当しない年もあり,2014
年の導入以来20 品目以下にとどまっている2)。
2024(令和6)度の薬価改定時に実施された,「ドラッグ・ラグ/ドラッグ・ロス解消に向けた革新的な医薬品のイノベーション評価」に関する制度改革では,この状況を鑑み,「革新的新薬を日本へ迅速に導入した場合の評価」として迅速導入加算が新設された。これは,先駆けでなくとも,他国の承認から時差なく(6
か月以内)日本で承認された製品を評価するものである。また,薬価算定時に規定され,その後の薬価維持に大きく関連するのが新薬創出加算である。2010
年の試行的導入から始まり見直しなどを経ながら実施されている新薬創出加算は,一定の要件を満たすと新薬の薬価が一定期間維持される仕組みである。当初製品に対する要件と企業に対する要件が設定され,双方を満たさないと加算の適用対象ではなかったが,企業要件が中小企業に不利に働いているという意見等も踏まえ,2024
年から企業要件,企業指標及び企業指標に基づく加算係数の設定(加算額の調整)は廃止となった。ただし,「企業ごとの開発状況を確認し,過去5
年間いずれの項目(表1 参照)も満たさない場合には,新薬創出等加算の加算対象外」という要件は残っている。
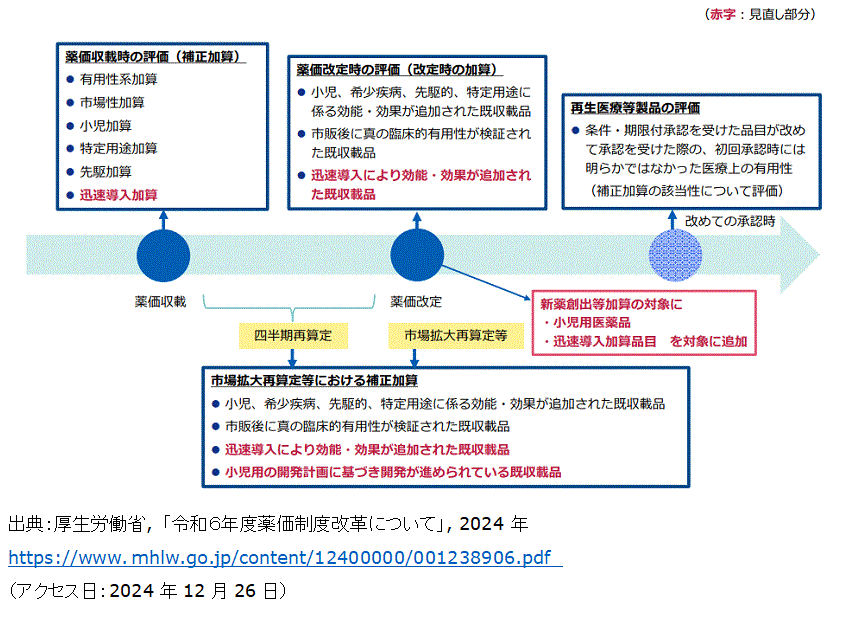
図2 薬価収載から収載後における評価のイメージ
表1 新薬創出加算* の確認事項

続いて,薬価改定に関連する例をいくつか挙げる。
●再算定のルール:日本では発売後隔年で薬価調査が実施され,実勢価格に基づき薬価が定期的に見直されている。また,2019
年から,実勢価格の調査で得られた平均の乖離率を超えた製品については毎年の改定が行われるようになった。さらに薬価改定の枠組みの中には,当初予定していた売上計画を大幅に上回って売れた製品などに対してさらなる価格是正策が盛り込まれている。その中に,市場拡大に伴う再算定が存在しているが,この仕組みに2016
年特例が生じ,その後特例再算定として四半期ごとの薬価改定が制度化された。これはある製品が対象人数の少ない希少癌で適応を取得し,その後徐々に対象人数の多い癌に適応拡大したことにより,当初の計画を大幅に上回り医療費に与える影響が少なくないと判断されたため,当初は特例として,その後制度として導入されている。
●中間年における薬価改定:薬価は従来2 年に一度の診療報酬改定年に薬価調査を経て薬価改定されていたが,2021
年より中間年(2 年毎の薬価改定の間の年)の改定が導入された。2023 年までは,薬価調査において薬価と実勢価格の平均乖離率を上回る製品が対象とされてきたが,中間年における改定についてさらに議論が進み,2024
年12 月の中医協総会の令和7 年度薬価改定の骨子(案)で中間年の薬価改定の対象が「平均乖離率5.2%を基準として,新薬創出等加算対象品目,後発医薬品についてはその1.0
倍,新薬創出等加算対象品目以外の新薬はその0.75 倍,長期収載品はその0.5 倍,その他医薬品はその1.0
倍をそれぞれ超える医薬品を改定対象」とする方向性が示された3)。これにより,中間年の薬価改定を受ける品目は拡大し,2466
億円の薬剤費削減との見通しが示された3)。一方で,「追加承認品目等に対する加算を臨時的に実施する。」との方向性も示され,イノベーションの評価の側面も改定に含まれている。今後はより詳細に区分された品目ごとの薬価改定の可能性が加速化すると考えられる。
●費用対効果評価:2016 年の試行的導入を経て,2019
年から本格導入している。費用対効果の評価対象となる要件を表2 に示した。この要件に該当するものとして,薬価収載時に指定を受けた製品は品目指定後速やかに分析のプロセスを開始し,9
か月間で企業の分析結果を提出することとなっている。その後,公的分析班における再分析や総合的な評価を経て最終的な評価結果が中医協で公示され,必要に応じて従来の薬価改定時期とは別に薬価調整が実施される。現在では,年間10
製品程度が対象となっており,2019 年からこれまでに59 製品が対象となっている。この中には,同じカテゴリーの先行品が既に費用対効果評価の対象となっており,独自で分析を実施するプロセスはないが,先行品の結果に応じて薬価改定のある製品も含まれている(カテゴリー:H5)。2024
年12 月時点で,41 製品が費用対効果評価を完了しており(H5 含む)4),多くの製品で薬価の引き下げが適用されている。なお,現行の制度では,費用対効果評価は薬価の調整に用いられ,薬価算定時の加算部分のみに対して調整が行われる。諸外国では,イギリスでは償還の可否に用いたり,フランスでは償還率の設定に直接用いられており,日本の制度とは異なっている面もある。
表2 費用対効果評価の選定基準

◆続きは「月刊PHARMSTAGE」2025年2月号 本誌でご覧ください◆
月刊PHARMSTAGEのホームページはこちら
https://www.gijutu.co.jp/doc/magazine_pharm%20stage.htm
参考文献
1)厚生労働省,「 新薬創出・適応外薬解消等促進加算について」,
2017年
https://www.mhlw.go.jp/file/05-Shingikai-12404000-Hokenkyoku-Iryouka/0000177146.pdf
(アクセス日:2024 年12 月26 日)
2)厚生労働省,「 令和 6年度薬価制度改革について」,
2024年
https://www.mhlw.go.jp/content/12400000/001238906.pdf
(アクセス日:2024 年12 月26 日)
3)厚生労働省,「 令和 7年度薬価改定の骨子(案)」,
2024年
https://www.mhlw.go.jp/content/10808000/001363462.pdf
(アクセス日:2024 年12 月26 日)
4)国立保健医療科学院 保健医療経済評価研究センター,「費用対効果評価の制度化以後(2019.4
〜)に選定された品目」, 2024 年
https://c2h.niph.go.jp/results/item.html
(アクセス日:2024 年12 月26 日)
|