|
�P�D�͂��߂�
�@�G�N�\�\�[���͍זE���番�傳��鎉����d���ň͂܂ꂽ���a50-150nm�̃i�m�T�C�Y�̏��E�����ł���B�^���p�N����microRNA�imiRNA�j�Ȃǂ̊j�_���܂݁C���������������܂܂�Ă��邱�Ƃ���C�זE�ԃR�~���j�P�[�V�����ɂ�����d�v�ȃ��f�B�G�[�^�[�Ƃ��ċ@�\���Ă���1�j�B�l�X�Ȑ����@�\��a�Ԕ��ǂƂ̊֘A����������钆�ŁC�����̌����҂��G�N�\�\�[�������Ö�Ƃ��ėp���ėՏ����p���邱�Ƃ�͍����Ă����B�G�N�\�\�[�������Ö�Ƃ��ėp���錤����2�ɑ�ʂ����B1�ڂ͍זE���番�傳�ꂽ�L���������܂ރG�N�\�\�[�������̂܂��Ö�Ƃ��Ďg�p������@�ŁC2�ڂ̓G�N�\�\�[����זE���g�ɗl�X�ȉ��H�������������Âɑ���G�N�\�\�[���̌��ʂ����߂���ό^�G�N�\�\�[���ł���B���Ì��ʂ̃��J�j�Y�����܂ߑO�҂̕C���Ɋԗt�n���זE�iMesenchymal
Stem Cell : MSC�j�R���̃G�N�\�\�[���Ɋւ��錤�������ɑ�������Ă���C�{�e�ł͓V�R�^�G�N�\�\�[���𒆐S�ɊT������B
�@�G�N�\�\�[�������Ö�Ƃ��ĉ��p���鎎�݂͗ǐ��C���������Ƃ��ɔ��ɑ���ɂ킽��B���̑S�Ă�������邱�Ƃ͍���ł��邽�߁C��\��Ƃ��āC�_�o�����E�t�����̐�s�������Љ����ɁC�M�҂�̌������Ői�߂Ă���ċz�펾���ɑ��錤�����������B�G�N�\�\�[���Ƃ������̂Ɋւ��āC���ۍזE�O���E�w��iISEV
: International Society for Extracellular Vesicles�j�͕�I�ȗp��Ƃ��āw�זE�O���E�iEVs
: Extracellular Vesicles�j�x�̖��̂��g�p����悤�ɐ������Ă���B�זE�O���E�ɂ͋N����T�C�Y�ɂ���ĕ����̃T�u�^�C�v�����݂��C�s�ψ�ȏW�c�ł��邱�Ƃ��������Ă��邽�߂ł���B�����_�ŁC���{��ł́g�G�N�\�\�[���h�Ƃ����P�ꂪ���y���Ă���C������₷���̊ϓ_�Ŗ{�e�Ɍ����Ắg�G�N�\�\�[���h�̖��̂��g�p���邱�ƂƂ��邪�C���m�ȗp��̎g�p�Ɋւ��Ă�MISEV2023�K�C�h���C���̋L�ڂ��Q�l�ɂ��邱�Ƃ𐄏��������B
�Q�D�G�N�\�\�[���������Ƃ��̋@�\
�@���a50-150nm�̃G�N�\�\�[���́C�זE���̃G���h�T�C�g�[�V�X�o�H�ŁC�G���h�\�[�����������֏o�肷�邱�Ƃɂ���Č`�����J�n�����B���E�́imultivesicular
body ; MVB�j���`�����ꂽ��ɁCMVB���זE���ƗZ�����邱�Ƃɂ��C�G�N�\�\�[�����זE�O�ɕ��o�����i����C���a100-1000nm�̃}�C�N���x�V�N���͒��ڍזE�O�ɍזE�����o�肷�邱�ƂŌ`�������ƍl�����Ă���j2�j�i�}1�j�B
�@�G�N�\�\�[���̎Y���̉ߒ��ŁC���̓����Ɂg�ωׁicargo�j�h�Ƃ��Ď����C�^���p�N����j�_�Ȃǂ����ڂ����B�G�N�\�\�[���͐e�זE������o���ꂽ��ɁC��̍זE�Ɏ�荞�܂�C
���́g�ωׁh����o���邱�ƂŁC��זE�ɃV�O�i����`�B���C���̕\���^�ɉe����^����3�j�B�Ⴆ�C�G�N�\�\�[������microRNA�́C�葤�̍זE�ň�`�q�����Ȃǂ𐧌䂷�邱�Ƃ��������Ă���4,5�j�B�����̌��ۂ́C�G�N�\�\�[���ɂ���čזE�ԃR�~���j�P�[�V�������s���C�אڂ���זE�݂̂Ȃ炸�̉t�ɗ��ꉓ�u����ɂ���p���邱�Ƃ������Ă���B�����̌������[�܂�ɂ�āC�G�N�\�\�[���͐��̓��̍P�퐫�̈ێ��⎾���̔��ǂɂ�����d�v�ȃ��J�j�Y�Ƃ��ċ@�\���Ă��邱�Ƃ�������C����ɂ͎��Ö��o�C�I�}�[�J�[�Ƃ��Ẳ\������������C�������������Ă���B
�R�D�G�N�\�\�[����p�����������ÂɊւ���
�@�G�N�\�\�[���̎��Ö�Ƃ��Ă̋��݂́C
�@�@ ������d���ň͂܂�Ă���C�̉t���ł��ɂ߂Ĉ���ł��邱��
�@�A ���l�ȓ�����ܗL���Ă���C�]���̃V���O���^�[�Q�b�g�ł͎��Â���������ɑ��ă}���`�^�[�Q�b�g�ȍ�p�����҂ł��邱��
�@�B �זE���ÂŖ��ƂȂ�}���Ɖu�����́C����זE�̗R���ɂ���Ă͏��Ȃ��Ƃ���Ă��邱��
����������B
�@�V�R�^�G�N�\�\�[�����Ö�̑�\��Ƃ��āCMSC�R���̃G�N�\�\�[���͂��ꎩ�̂����Ö�Ƃ��Ē�Ă���Ă���BMSC�͑̓��̑����̑g�D�ɑ��݂���זE�ŁC���b�g�D�C�`�ь��C�ٔՁC�����ȂǗl�X�ȑg�D���番���\�ł���C�l�X�ȍזE�ւ̕����\��L����B�����MSC�͖�������Ԃʼn��Ǘ}���E�זE���B���i�Ȃǂ̌��ʂ�����T�C�g�J�C���E���B���q�傷�邱�Ƃőg�D�C���𑣂����Ƃ��������Ă���7�j�B�����CMSC�ɍR���nj��ʂ����邱�Ƃ���C�l�X�Ȏ����ł̎��É��p���i��ł������CMSC�͌��Ǔ��ɓ��^������C�э��ǃ��x���łقƂ�ǂ��������W�I����ɂ͏����������B���Ȃ����Ƃ�������8�j�C����Ɏ��Ì��ʂ̔}��E�S����Ƃ��āCMSC�̕��傷��̉t���q��G�N�\�\�[�������ڂ����悤�ɂȂ����BMSC�R���̃G�N�\�\�[���ɂ�MSC�R����mRNA�����miRNA�C�T�C�g�J�C���C�P���J�C���C�Ɖu���߈��q����ѐ������q���L�x�Ɋ܂܂�8�j�CMSC���l�ɖƉu���߁E�R���nj��ʂ�L���邱�Ƃ���C�l�X�Ȏ����ւ̎��Âɉ��p�ł��Ȃ�������������Ă���Ƃ���ł���B�e�����ɂ����Ăǂ̂悤�Ɏ��Ì��ʂ������炷���Ƃ������J�j�Y����������������ł���C���̈ꕔ�Ɋւ��Ă͊e�_�ŏq�ׂ�B
�@�V�R�^�G�N�\�\�[���ɍH�w�I�ȉ��ς������邱�ƂŁC����Ȃ鎡�Ì������̌����ڎw�����ό^�G�N�\�\�[���̌���������B�G�N�\�\�[���̕\�ʃ��K���h��ω������ĕa�ςւ̑��B�\�����コ���邱�Ƃ��\�ƍl�����Ă���9�j�B�܂��C�G�N�\�\�[���ɖ�܂�j�_�������邱�Ƃ��\�ł���C�G�N�\�\�[�����ܑ��B�v���b�g�t�H�[���Ƃ��ėp����J�����i��ł���9�j�i�}1�j�B
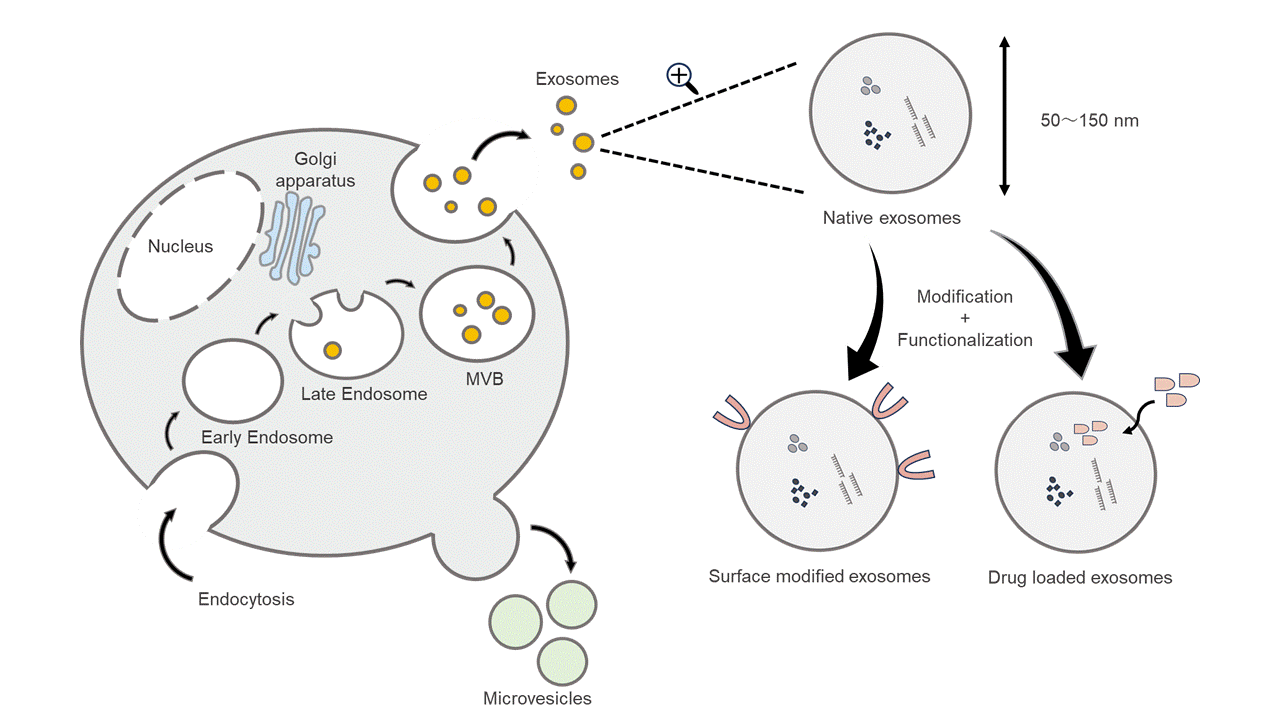
�@�}�P�@�G�N�\�\�[���̐����o�H�A�V�R�^�G�N�\�\�[���E���ό^�G�N�\�\�[���ɂ���
�@�@�@�i�����j
�U�D�x�����ւ̃G�N�\�\�[������
�@�x�����ɂ͔x���E�C�ǎx���C�C�ǎx�b���C�Ԏ����x���^�������x���ۏǁC�����ǐ��x�����iChronic
Obstructive Pulmonary Disease : COPD�j�ȂǁC����ɂ킽�鎾�������݂���B�x�����փG�N�\�\�[�����Â����p����ۂ̑傫�ȓ����͋z���Ö@��I���ł��邱�Ƃł���B�G�N�\�\�[���͒��a50-150nm�̃i�m�T�C�Y�̏��E�����ł���C�l�u���C�U�[�ȂǂŖ���ɂ��C������z������ƒ��ځC�x�����̎���ł��閖���C����x�E�̈�ɓ͂��邱�Ƃ��\�ƂȂ�B�V�K��܂̎��É��p�̏ꍇ�́C�a�C�̂��鑟������������B�����邩�Ƃ����_���d�v�ƂȂ�B�G�N�\�\�[����_�H�œ��^����ƌ����ɏ���đS�g�֕��z���邱�Ƃ���C�W�I����ւ̓��B���Ƃ����ϓ_�ʼnۑ�_�����邪�C�z���Ö@�̏ꍇ�͒��ڔx�ɓ��B�����邱�Ƃ��ł����^�e�ʂ��}���邱�Ƃ��ł��邱�Ƃ���C��ܑ��B������S���̊ϓ_�ŗD�ʐ��������B�����_�ł́C�������f���ւ̃G�N�\�\�[���̐Ö������^�ɂ�鎾���ւ̌��ʂ�]���������������C�G�N�\�\�[����x�����ɉ��p����ۂɂ́C�Ö������˂Ȃ̂��C�Ǔ����^�i�l�u���C�U�[�܂ށj�Ȃ̂��Ƃ������^�o�H���l�����ׂ��ł���B
6.1�@�������x���ۏ�
�@�������x���ۏǁiidiopathic pulmonary
fibrosis : IPF�j�͔x�̊Ԏ��̐��ۉ�������Ƃ��閝���i�s���̎����ł���C�\��s�ǂł���35�j�B���݁C�g�p�\�ȍR���ۉ���̓s���t�F�j�h���ipirfenidone�j��j���e�_�j�u�inintedanib�j��2��ނ݂̂ł���C�����̖�܂͐i�s�}���̌��ʂ�������Ă���B�������x���ۏǂ̎��Ö�Ƃ��ăG�N�\�\�[�����g�p���鎎�݂͑������Ɠ��l��MSC�R���̃G�N�\�\�[���̕������B�܂��C�q�g�C�����זE�iHuman
Bronchial Epithelial Cells : HBEC�j�R���̃G�N�\�\�[���̎��É��p���������i��ł���B
�@Mansouri��́C�q�g�����R��MSC�iBone marrow -derived mesenchymal
stromal cell : BM-MSC�j�̃G�N�\�\�[���̒P��Ö������˂ɂ��}�E�X�̃u���I�}�C�V���U�����x���ۏǂ����P�����邱�Ƃ������B���̒̕��ł́C�R���ǐ��̃}�N���t�@�[�W�̗U���ɂ����ۉ������P����Əq�ׂĂ���36�j�B���ۉ��̉��P�̃��J�j�Y���̌����͑��̌����O���[�v������������Ă���CWan��́CBM-MSC�R���̃G�N�\�\�[�����CmicroRNA-29b-3p����āC���ۉ�זE��frizzled6�iFZD6�j�̔������_�E�����M�����[�g���邱�Ƃɂ��C���ۉ�זE�̑��B��}�����C�}�E�X��IPF�̐i�s��}�����邱�Ƃ�������37�j�B�����āCZhou��́C�q�gBM-MSC�R��EV���ɑ��݂���microRNA-186��SOX4
�� DKK1�̔�����}�����邱�ƂŁC���ۉ�זE�̊��������j�Q�����ƕ���38�j�BIPF�ւ̎��É��p�Ƃ��Ă̌����́C���ɂ��q�g�`��MSC�̃G�N�\�\�[��39,40�j�C�q�g���o���R���q�{�������זE�̃G�N�\�\�[��41�j�C�q�g�r�����זE�̃G�N�\�\�[��42�j�Ȃǂ�IPF�̃}�E�X���f���ŕ���Ă���B
�@��X�̌������ł́C�q�g�C�����זE�iHuman Bronchial Epithelial
Cells : HBEC�j�R���̃G�N�\�\�[�����CMSC�R���̃G�N�\�\�[���Ɣ�r���āC�������I��TGF�|���U�������ۉ�זE�̕����ƋC�����זE�̘V���������I�ɗ}�����邱�ƂŁCIPF�ւ̌��ʂ����邱�Ƃ����43�j�BHBEC�͋C�����זE�̒��ł�p63�y��KRT5�z���̊��זE�̌`����L���C�S�t�זE����я��ɕ��������C����progenitor�זE�ł���BHBEC�R���G�N�\�\�[���̎��ÓI���ʃ��J�j�Y����RNA-seq�ɂ���͂��CIPF�̔��Nj@���Ɋ֗^���Ă���Ƃ����ÓT�I����є�ÓT�IWNT�V�O�i���`�B�o�H�̗������֗^���Ă��Ă��邱�Ƃ����炩�ɂȂ����B�����āCHBEC�̃G�N�\�\�[���̓����ɑ��݂���microRNA��TGF�|����WNT�ɂ��V�O�i���`�B��}�����������S���Ă��邱�Ƃ����������B�i��̓I�ɂ́CmiR-26a,
miR-26b, miR-141�C�����miR-200a�́CHBEC�Ɣx���ۉ�זE�̗����Ŕ�ÓT�IWNT5A��W�I�Ƃ��CmiR-16��miR-148a�͔x���ۉ�זE�̌ÓT�IWNT10B��W�I�Ƃ��CmiR-16��HBEC�̌ÓT�IWNT3A��W�I�Ƃ���j�B�{�����ł�HBEC�R���̃G�N�\�\�[����ɂ��ă}�E�X�ɋC�Ǔ����^���邱�Ƃɂ��IPF�ւ̌��ʂ����邱�Ƃ�������43�j�B������HBEC�R���̃G�N�\�\�[����IPF�֎��Ö�Ƃ��ėՏ����p���邽�߁C�Տ��O���[�h�̐��܊J����ڎw���ē��X������i�߂Ă���B
�Q�l����
1�jFujita, Y. et al. Trends
Mol. Med. 21, 533-542 (2015)
2�jKumar, M. A. et al. Signal Transduct Target
Ther 9, 27 (2024)
3�jLiu, Y. -J. & Wang, C. Cell Commun. Signal.
21, 77 (2023)
4�jKosaka, N. et al. Journal of Biological Chemistry
285, 17442-17452 (2010)
5�jPegtel, D. M. et al. Proc. Natl. Acad. Sci.
U. S. A. 107, 6328-6333 (2010)
6�jPhinney, D. G. & Pittenger, M. F. Stem Cells
35, 851-858 (2017)
7�jToma, C. et al. Circ. Res. 104, 398-402 (2009)
8�jHarrell, C. R. et al. Cells 8, 467 (2019)
9�jHerrmann, I. K. et al. Nat. Nanotechnol. 16,
748-759 (2021)
35�jLederer, D. J. &
Martinez, F. J. N. Engl. J. Med. 378, 1811-1823
(2018)
36�jMansouri, N. et al. JCI Insight 4, (2019)
37�jWan, X. et al. J. Cell. Physiol. 235, 8613-8625
(2020)
38�jZhou, J. et al. Stem Cell Res. Ther. 12, 96
(2021)
39�jShi, L. et al. Stem Cell Res. Ther. 12, 230
(2021)
40�jXu, C. et al. Stem Cell Res. Ther. 11, 503
(2020)
41�jSun, L. et al. Oxid. Med. Cell. Longev. 2019,
4506303 (2019)
42�jTan, J. L. et al. Stem Cells Transl. Med. 7,
180-196 (2018)
43�jKadota, T. et al. J Extracell Vesicles 10,
e12124 (2021)
|