|
�P�D�͂��߂�
�@2014�N�� �u���i�C��Ë@�퓙�̕i���C�L�����y�ш��S���̊m�ۓ��Ɋւ���@���v�i��@�@�j���{�s����C�Đ���Ó����i�ɂ��Ă̋K�肪�܂܂�邱�ƂƂȂ�10�N���߂��܂����B���̊ԁC��@�@�{�s�O�ɉʊ��Ɏ��g��2���i������21���i�i�זE���Ð��i17�i�ځC��`�q���Ð��i4�i�ځj�����F����Ă��܂��B�܂��C���������������ꂽ���{�ɂ�����Đ���Ó����i�̎��p���ɑΉ��������F���x�i�����y�ъ����t�����F�j��5���i�i�A�N�[�S���܂ށj�ɓK������C�u�����y�ъ����t���v�����̔����F�ƂȂ��Ă��܂��B
�@�Đ���Ó����i�ɂ́C�זE���Ð��i�ƈ�`�q���Ð��i���܂܂�C����܂ł̈��i�̃��_���e�B�ł͍����ł��Ȃ��������������Âł���\�����߂Ă��܂��B�������Ȃ���C�זE���Ð��i�C��`�q���Ð��i���ꂼ��ɐV���ȃA�v���[�`���܂܂��悤�ɂȂ��Ă��Ă���C�����ڐ��ŋc�_����̂�����Ȃ��Ă��Ă���̂������ł��B�����C���ʂ��čĐ���Ó����i�ł́C����܂ł̈��i�Ƃ͑傫���قȂ����������@��ۊǁC�z�����K�v�ł���C���Ɛ��]���ł͒��ӂ���K�v������܂��B���n���ƂƂ��ẮC�̎Z�������邱�Ƃ��d�v�ł���C�Ԏ��ł�������𑱂��邱�Ƃ͍���ƂȂ�܂��B�M�҂̉ߋ��̌o���i���ƗR���זE���H���i�j�𒆐S�ɏ����ł��Đ���Ó����i�̊J�����i�̎Q�l�ƂȂ�ƍK���ł��B
�@�����āC���Ɛ��̊ϓ_�ōl���������鎖�ۂ��N���Ă��܂��̂ō��킹�ċc�_���Ă��������Ǝv���܂��B
�Q�D�Đ���Ó����i�Ƃ́H
�@���āC�Đ���Ó����i�Ƃ͂Ȃ�ł��傤���H
�@��@�@�̒��ł͍Đ���Ó����i�ɂ��Ă͐}1��}�̂悤�ɒ�߂��Ă��܂��B���o�����זE�ɉ��H���{�����Ƃ��K�{�ƂȂ��Ă��܂��B�]���āC����ڐA���͂��̖@���̃X�R�[�v����͊O��Ă��܂��B���̈���ŁC�l�I�ɂ́C�u����������e�Ȃ��v�Ƃ����̂�����ۂł����B
�@�ł́C���̒��ɂǂ̂悤�Ȃ��̂��܂܂��̂��C���ނ����̂��ɂ��ẮCAMED�̈ϑ��ɂ��A�[�T�[
D. ���g���̎���1�j�ɏ�肭�܂Ƃ߂��Ă��܂��B�������Ȃ���C�ߔN�C�l�X�ȐV�K�Z�p�C�A�C�f�A�C�Ⴆ�C��`�q�ҏW�CTCR-T�C�G�N�\�\�[���C�I���K�m�C�h���X�V���ȃA�v���[�`���s���Ă��Ă��܂��B�Đ���Ó����i�Ə\�c�ꗍ�̋c�_�͓���Ȃ��Ă��Ă��܂��B�}�P���}�ł́C�A�[�T�[
D. ���g���̎����ɐV�����Z�p��⑫���Ă��܂��B
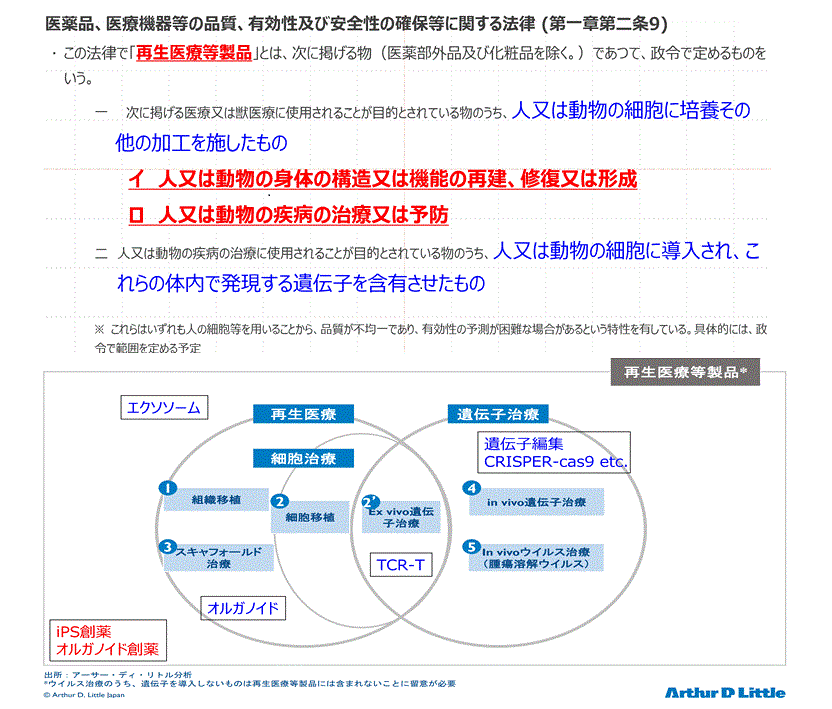
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�}�P
�R�D�Đ���Ó����i�̍��N�̃G�|�b�N���C�L���O�ȏo�����ɂ���
�@���N�i2024�N�j�ɂ́C�u�����y�ъ����t�������̔����F�v���^����ꂽ2���i�ɂ��Ďs�̌�Տ�������C2���i�Ƃ��s�ꂩ��P�ނ��Ă��܂��B��`�q���Ð��i�̃R���e�W�F���͏��F��艺���C�̔��I��2�j�i�s�̌�Տ��̌��ʕ]���ɂ��Ă͌��\����Ă��܂���B�j�C�܂��C�זE���Ð��i�ł���n�[�g�V�[�g�́u�����J����
�R�c��i�Đ���Ó����i�E�����R���Z�p����j�ł̐R�c�̌��ʁC���F���邱�Ƃ͓K�ł͂Ȃ��Ɣ��f���ꂽ�v�Ƃ̂��ƂŔ̔��𒆎~���܂���3�j�B���̂��Ƃ́u�����y�ъ����t�������̔����F�v���x���@�\�����ƍl����ׂ��Ȃ̂ł��傤�B
�@�܂��C�זE���Ð��i�ł���A�N�[�S®�ɂ��ẮC�u�����y�ъ����t�������̔����F�v�擾�������̂̂��̏o�ׂɂ́u����̏��F�ɔ����o�ׂɊւ��������B�����邽�߁C���Ђ͍��㑬�₩��2����x�̎s�̕i�������s���܂��B�v�ƈٗ�̏������t���Ă��܂�4�j�B
�S�D���Ɛ��]���̏d�v��
4.1 ���Ɛ��]���ɗp��������@
�@���Ɛ��]���ɂ́C�����ɂ�萶�ݏo���ꂽ�t���[�L���b�V���t���[�����݉��l�Ɋ���߂���Net
Present Value�iNPV�j��p�����������f�E�o�ω��l�̑���@��p���邱�Ƃ������̂ł͂Ȃ��ł��傤���BNPV��p����ƁC���ׂĂ̈Č����L���b�V���t���[�Ƃ������ʂ̎��ő���E�]���ł��郁���b�g������܂��B
�܂��C�������ɁC���̊�Ƃ����ϓI�ɂǂ̂��炢�̃R�X�g�Ŏ����B���Ă���̂��CWeighted
Average Cost of Capital�iWACC�j�C���l�������n�[�h�����[�g��p����C���Ԃ̊T�O�E���X�N�̊T�O�����������]�����\�ƂȂ�܂��B�ܘ_�C����Ƀf�V�W�����c���[���́C�����e�J�����@�C�����ă��A���I�v�V�����@�ȂǁC�_���X�N���܂�@�Ȃǂ�����܂����C�e��Ƃŗp�����Ă����@��p���邱�ƂƂȂ�܂��B�P���Ɍ����CNPV�̒l���}�C�i�X�ɂȂ�悤���ƁC���̃v���W�F�N�g�͂��Ȃ��Ƃ̔��f�ɂȂ�܂��B
�@���Ɛ��]���ɂ́C���̃v���W�F�N�g�ɕK�v�ȃR�X�g�Ə����̔�������ς����Čv�Z���邱�ƂɂȂ�܂��B�Đ���Ó����i�ɂ����ẮC���̃��_���e�B�Ƃ͏����قȂ������ӓ_������܂��B�ȉ��C���̌��ς���Œ��ӂ��ׂ��_�ɐG��Ă����܂��B
4.2 ���Ɛ��]���ōl�������p�����[�^�[
�i1�j�R�X�g
�@�Đ���Ó����i�ł����Ă��ʏ�̎��Ɛ��]���ɗp����p�����[�^�[�Ɖ���قȂ�Ƃ���͂Ȃ��̂ł����C���ɍזE���H���i�̏ꍇ�ɂ́C�@
�זE�͐����Ă���C�A ���ہC�E�ۂ��ł��Ȃ��C�B �o�������ł���זE�i�g�D�j�̕i���̓o���o���ƌ����_��F�����Ă����K�v������܂��B�זE�������Ă���ƌ������Ƃ͍זE������ł����Ƃ����������邱�Ƃ��ł��܂��B���̂悤�ȓ���������Ȃ��ŁC�����ʂɂ��Ă͂悭�l���Ă����K�v������܂��B�܂��C�s�̌�ɂ��S�ᒲ�����v������܂��̂ʼnc��
�E PMS�Ŕ��������p���l�����Ȃ��ƂȂ�܂��C������ΏۂƂ���ꍇ�ɂ͊����̂ɒ��ӂ��ׂ���p������܂�5�j�B�����āC�J�����i������Ȃ���̓����ɔ����ꎞ����C�����e�B�[���K�v�ƂȂ�܂��B
�@�ȉ��ɁC�Đ���Ó����i�Œ��ӂ��_���q�ׂĂ݂܂��B
�Q�l����
1�j2019 �N�x �Đ���ÁE��`�q���Â̎s�꒲���Ɩ��i2020�N03���j����
2�j�A���W�F�X�Ѓv���X�����[�X 2024�N6��24���uHGF ��`�q���×p���i�u�R���e�W�F���v
�̊J���̔��헪�̕ύX�Ɋւ��邨�m�点�v
3�j�e�����Ѓv���X�����[�X 2024�N7��20���u�����J���� �R�c��ɂ�����u�n�[�g�V�[�g�v�̐R�c���ʂɂ��āv
4�j�T���o�C�I�Ѓv���X�����[�X2024�N6��24���u�A�N�[�S®�]���ڐA�p���v�Ɋւ���ꕔ�ɂ��āi����j�v
5�j�u���a�p���i���i�̊J�������ł̎��Ɛ��]���v PHARM STAGE 14-19
Vol. 23 No. 4 2023
|