|
1.はじめに
PQS(医薬品品質システム)を実行する手順として,監査を行う必要性がある。品質方針及び品質目標を達成するために,製造部門,品質部門が業務を行っていることを確認する。この場合,GMP管理の一員として,原料や資材の供給者や外部試験検査機関,設備等の点検,校正など外部委託業者が行っている業務について,チェックをしなければならない。その管理について,監査をする必要がある。
製造販売業者がGQP管理として,製造委託先に対して監査を行う場合,その製剤製造業者や原薬製造業者のGMP管理について,PQS(医薬品品質システム)が適切に稼働していることを確認しなければならない。
2.GMP PQS実効性の監査
2.1 GMP PQSでの実効性とは
PQS(医薬品品質システム)実効性の監査として行うべきポイントを考える。ここで,GMP省令第3条の2の条文を確認する。
第三条の三 製造業者等は,実効性のある医薬品品質システムを構築するとともに,次に掲げる業務を行わなければならない。
一 製品品質を確保するための基本的な方針(以下「品質方針」という。)を文書により定め,当該文書に医薬品品質システムの手続等の構成要素を示すこと。
二 法第十七条第六項に規定する医薬品製造管理者及び法第六十八条の十六第一項に規定する生物由来製品の製造を管理する者(外国製造業者にあっては,法第十三条の三第一項の認定を受けた製造所の責任者又は当該外国製造業者があらかじめ指定した者)(以下「製造管理者」と総称する。)又は第四条第三項第一号に規定する品質保証に係る業務を担当する組織に,品質方針に基づいた製造所における品質目標を,文書により定めさせること。
三 製造所において医薬品品質システムに関わる全ての組織及び職員に対し,品質方針及び品質目標を周知すること。
四 品質方針及び品質目標を達成するため,必要な資源(個人の有する知識及び技能並びに技術,設備その他の製造所における製造管理及び品質管理に活用される資源をいう。)を配分するとともに,定期的に医薬品品質システムを照査し,その結果に基づいて所要の措置を講ずること。
五 前二号の業務に係る記録を,あらかじめ指定した者に作成させ,これを保管させること。 |
製造業者が品質システムを構築するうえで,品質方針を立て,品質システムとして手順を定めることが必要である。その方針や目標を企業内のGMPに関連する組織,職員に周知しなければならない。
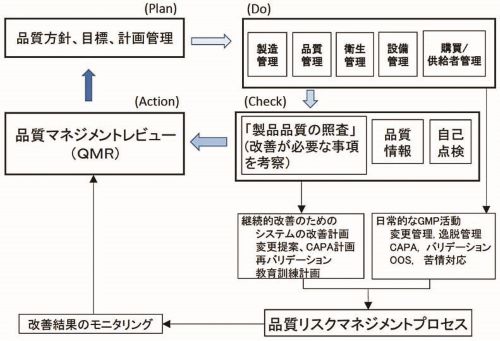
図1 医薬品品質システムにおけるリスクマネジメントを活用した継続的改善(PMDAのHPより)
購買,供給者管理の担当者は,品質方針,品質目標に合致する原料資材を購買することが求められる。また,工場内の設備の製造や点検整備,製造室や試験室など清掃などを外部委託業者が行った作業を適切であるか確認しなければならない。製造業として,品質方針,品質目標に合致していることを確認することが監査のポイントとして,最も重要な点である。
2.2 原料等の供給者管理
原料等の供給者管理についてGMP 省令1)第11条の4を確認する。
(原料等の供給者の管理)
第十一条の四 製造業者等は,品質保証に係る業務を担当する組織に,手順書等に基づき,次に掲げる業務を適切に行わせなければならない。
一 原料等の品質の確保のために適切な規格を定めること。
二 原料等の供給者について,適格性を評価した上で選定すること。
三 原料等の製造管理及び品質管理が適切かつ円滑に行われているかどうかについて定期的に確認すること。
四 前三号の業務に係る記録を作成し,これを保管すること。 |
原料等の製造管理及び品質管理が適切かつ円滑に行われているか定期的に確認することが求められている。原料の製造業者がGMP管理の対象でない場合も含まれる。「定期的な確認」について,GMP事例集を確認する。
GMP11の4-7(原料等の供給者の管理)
[問] GMP省令第11条の4第1項第3号に「定期的に確認する」とあるが,どのように実施すればよいか。
[答] 例えば,次の対応が考えられる。原料等の供給者の製品である当該原料の製造管理及び品質管理が適切であるかを原料等が製品品質に及ぼす影響の程度並びに供給者の評価に応じて計画的に監査(実地又は書面)で確認したり,製品品質の照査等のタイミングで,原料等の品質等に起因する事象を確認し,当該原料等の品質が適切に確保されているか,また,改善すべき事項を以前に指摘している場合は,それらの事項が適切に改善されているかを確認する。そして,それらの結果及びリスクに応じ品質保証に係る業務を担当する組織が必要と判断した場合は,当該原料等の供給者に対する追加の監査(実地又は書面)により,当該原料等の製造管理及び品質管理の方法を確認する。
なお,原薬たる医薬品のように製造販売業者が供給者(原薬たる医薬品製造業者等)と取決めを締結している場合は,GMP11の4−6に記載の方法で確認することもできる。
GMP11の4−8(原料等の供給者の管理)
[問] 原薬たる医薬品の安定性モニタリングの結果を製剤の製造所が入手し,保管する必要があるのか。
[答] 原料等の供給者管理における取決めに定めるなど,少なくとも,原薬たる医薬品の安定性モニタリングにおいて,好ましくない傾向が確認された場合,あるいはOOS又はそのおそれが発生した場合に,製剤の製造業者等が速やかに情報を入手できる体制を構築しておく必要がある。
原料製造業において,GMP管理の対象でない場合も含め,原料等が製品品質に及ぼす影響について,監査で確認することが求められている。
GMPとして求められている品質システムのまま,GMP管理の対象でない原料製造業者に対して求めるのではなく,医薬品製品としての品質に影響するリスクがないか,また,リスクがある場合,そのリスクが発生しない対策を行っているか確認する必要がある。原料製造業者に対して,GMPの品質システムのまま求めるのではなく,製品品質に影響するリスクの有無を確認し,その対策が行われているかを確認する必要がある。
|
原料製造業において,GMP管理の対象でない場合も含め,原料等が製品品質に及ぼす影響について,監査で確認することが求められている。
GMPとして求められている品質システムのまま,GMP管理の対象でない原料製造業者に対して求めるのではなく,医薬品製品としての品質に影響するリスクがないか,また,リスクがある場合,そのリスクが発生しない対策を行っているか確認する必要がある。原料製造業者に対して,GMPの品質システムのまま求めるのではなく,製品品質に影響するリスクの有無を確認し,その対策が行われているかを確認する必要がある。
また,原薬としての安定性データを確認するだけでなく,医薬品製剤の品質に影響する可能性を考慮し,製剤の安定性に影響する点の有無について,確認しなければならない。製剤としての安定性に影響するリスクを踏まえて,原料の品質リスクを確認することが求められる。
2.3 外部委託業者の管理
3 GQP品質管理業務
3.1 適正な製造管理及び品質管理の確保
3.2 承認事項の遵守
◆続きは「月刊PHARMSTAGE」2024年10月号 本誌でご覧ください◆
|