|
�P�D�͂��߂�
�@�Đ���Ó����i�́C�������זE���`�q��p���Ċv�V�I�Ȏ��Ö@�������̂ł���B�Ⴆ�C���זE��p�����g�D�Đ����`�q���Âɂ���`�������̎��Â���������B����ɂ��C��a���Â⑹�������g�D�̍Đ����\�ƂȂ�C���҂̐����̎����啝�Ɍ��シ�邱�Ƃ����҂����B
�@�������C���̐��i�J���E���Ɖ��ɂ͑����̋Z�p�I�ۑ�
�����݂���B�Ⴆ�זE���H���i�ɂ����ẮC�g�p����זE�̊m�ۂ���H���ł̕i���Ǘ����d�v�ł���C�ώ����ƈ��萫�C���ې������m�ۂ���K�v������B��`�q���×p���i�ɂ��ẮC�E�C���X�x�N�^�[�̍R������s���S�̂̍��݂Ȃǂ��ۑ�ł���C���i�̏��x�����߁C���S���ƗL���������P���邱�Ƃ����߂���B���Ȃ킿�C�����͈��i�Ƃ͈قȂ�@�K������Z�p���v������邽�߁C�������n�m���C���i���Ƃ̐헪�I�ȕi���Ǘ��Ǝ��ƌv��𗧂Ă邱�Ƃ��d�v�ł���B�@�{���|�[�g�ł́C�Đ���Ó����i�̎��ƍ\�z�ɕK�v�Ȑ��i�R���Z�v�g�Ɛ����E�J���헪�ɂ��āC�ŐV�̌��������⎖������Ƃɐ�������B
�Q�D�Đ���Ó����i�̒�`�Ɩ@�̌n
�@���{�ɂ�����Đ���ẤC��t�̈�Ís�ׂɊւ���Đ���È��S�m�ۖ@�i���m�@�j1�j�ƁC�Đ���Ó����i����`����Ă�����i��Ë@�퓙�@�i��@�@�j2�j�ɂ���ċK������Ă���B���i�̊J���҂���҂́C�����̋K�������炵�C�K�ȕi���Ǘ��ƗՏ����������{���邱�ƂŁC���i�̎s�����ڎw�����Ƃ��ł���B
�@�Ȃ��C���݁C���{�ŏ��F����Ă���Đ���Ó����i�́C�������i�H�i�q���������iNIHS�j�̍Đ��E�זE��Ð��i��3�j�C�i�Ɓj���i��Ë@�푍���@�\�iPMDA�j�̃z�[���y�[�W4�j�ɂďڂ�����������Ă���̂ŎQ�Ƃ��ꂽ���B
2.1 �Đ���Ó����i�̎���
�@�Đ���Ó����i�́C���̎�ނ�p�r�ɉ����đ���ɂ킽��5�j�B�J�����̂��̂��܂߁C��̓I�ɂ͈ȉ��̂悤�Ȑ��i���܂܂��i�\1�j�F
�@ �q�g�̍זE���H���i�F���Ҏ��g�̍זE��h�i�[����̎悵���זE���זE���H�{�݁iCell Processing
Centore,CPC�j�ɂĔ|�{�E���H���C���Âɗp���鐻�i�ł���B�Ⴆ�C���ۉ�זE��ԗt�n���זE�iMesenchymalStem
Cells, MSCs�j��p�����g�D�Đ���C�Ɖu�זE��p�������Â���������B����ɁC���Ҏ��g�̍זE��CPC
�ɂĉ��H���C���҂ɖ߂��u���Ɓv�ƁC���N�ȃh�i�[������ꂽ�זE�����炩����CPC �ɂĉ��H���ĕi���K�i���߂ĕK�v���Ɋ��҂Ɏg�p����u���Ɓv�ɑ�ʂ����BCAR-T
�Ö@�Ɋւ��ẮC�q�g�̍זE���H���i�ɋ敪����邪�Cex vivo ��`�q���ÂƂ��Đ��������ꍇ������B
�@ �ǂ̍זE�������Ƃ��đI�����邩�͏��i�R���Z�v�g���m�����邤���ŋɂ߂ďd�v�ł���BiPS
�זE�͑̍זE�ɐ���̈�`�q�i�R�����q�j�����č쐬�����זE�ł���C�������䂪�ۑ�ł���B�܂��C�̐����זE�ɂ��ẮC�����⎉�b�זE�R�����g�p����Ă��邪�C�����o���N�Ɠ��l�C��N�w�̃h�i�[�m�ۂ�זE������ۂ����ł̌p��|�{�̉Ɍ��E�����邱�ƂȂǂ��ۑ�ł���B�Ȃ��C�䂪���ł̍זE�����̊m�ۂɂ����Ă͒鉤�؊J���̑ٔՂɊ܂܂��c�N���̊��זE�𗘗p���鎎�݂����邱��6�j�C�܂��C�̐����זE�ł����������R�����זE�͐_�o�n�ւ̕����\�ɗD��Ă���7�j�Ȃǂ̓���������B
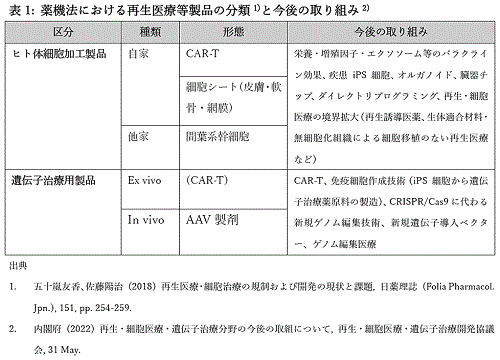
�A ��`�q���×p���i�F�����̌����ƂȂ��`�q�̌�����ُ���C�����邽�߂ɁC���ÂɕK�v�Ȑl�H��`�q�����҂ɓ��^���鎡�Ö@�ł���B����ɂ́C�E�C���X�x�N�^�[��p���Đl�H��`�q�����җR���̍זE�ɓ������Ă��炻�̍זE�����҂ɓ��^������@�iex
vivo�j�ƁC�l�H��`�q�ڊ��҂ɓ��^������@�iin vivo�j�ɑ�ʂ����B
�B �����J�����̍Đ���Ó����i�F���݁C�����J�����̐��i�ɂ́CiPS�זE��p�����זE�V�[�g�C�I���K�m�C�h�C�Q�m���ҏW�����p�����f�U�C���זE�Ȃǂ���������BCAR-T�͊��Ҏ��g��T�זE�𗘗p���邪�C�����R����ܓ��^�ɂ��_���[�W����g�p�ł��Ȃ�������邽�߁C��`�q���ς�������T�זE�������Ɏg�p���鎎�݁i����CAR-T�Ö@�j���J���������8�j�B�Ȃ��C���זE�̔|�{�㐴�Ɋ܂܂��G�N�\�\�[�������Âɗ��p���鎎�݂����邪�C���̖@�I�J�e�S���[�ɂ��Ă͂܂����m�ɂȂ��Ă��Ȃ�9�j�B�܂��C��`�q���ÂɎg�p�����A�f�m�����E�C���X���x�N�^�[�iAAV�j�͍R�����������ɔ������邱�ƁC�m���̖��Ȃǂ̗��R����C�����ł͑�փx�N�^�[���J�����铮��������B
�R�D���i�R���Z�v�g�̍\�z
�@�Đ���Ó����i�́C�]���̈��i�Ƃ͈قȂ��������і�p�����C�V�K�̃R���Z�v�g���\�z�ł���\��������B�Ƃ͂����C���҂ł���u�Đ��v�͈̔͂ɂ͌��E������B���̃����b�g�ƃf�����b�g�ɂȂ��鐻�i�������\���ɕ]�����C�u�g�̏�ɍ��������i�R���Z�v�g�v�Ɏd�グ��K�v������B���̂��߂ɂ́C��Ãj�[�Y�C�Z�p�I�\���C�@�K���̖ʂ���̕]���Ƌ�̉����K�v�ł���B
3.1 ��Ãj�[�Y
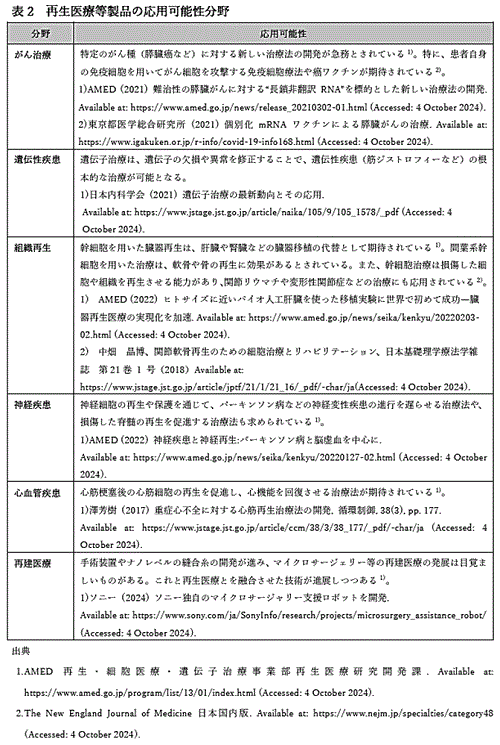
�@ �^�[�Q�b�g�s��̓���ƁC���҂��Ë@�ւ̎��Ãj�[�Y���ڍׂɒ������C���i���g�p�����ۂ̎��ƃV�~�����[�V�������s���B
�A ���s�̎��Ö@�⋣�����i�̕��͂��s���C���Ï�̈ʒu�Â��⑼�Еi�Ƃ̍��ʉ��|�C���g�m�ɂ���B
�@���݁C�u�q�g���זE��p����Տ������Ɋւ���w�j�v10�j�Ɋ�Â����l�X�ȗՏ��������s���Ă���B�i�\2�j�B�������C�Đ���Ó����i�̖͑����ɍ��z�ł��邽�߁C���̎��Ì��ʂⓊ�^�Ȃǂ����҂̌o�ϓI���S�y����QOL����Ɍ��т��K�v������B
3.2 �Z�p�I�\��
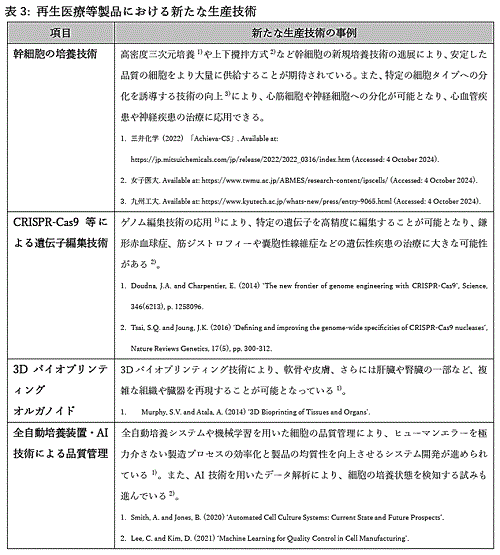
�@�ŋ߂ł͑�w�⌤�����Ȃǂő����̐V�����Z�p���J������C�V�K�ȍזE�E��`�q���Ð��i��₪���X�Ƒn�o����Ă���i�\3�j�B�������C�����̎��Ɖ���i�߂�ꍇ�CGCTP�ȗ�11�j�K�����̐����Ǝ҂ɋZ�p�ړ]���s���K�v������B�Đ���Ó����i�ɂ����ẮC�������b�g�Ԃ̕s�ψꐫ��ٕ������C�������荢��ɂ����苟���Ȃǂ̐����ɂ�����ۑ�ɂ��C�������F������t�����F�i�K�ł̒��f��P�ނ�]�V�Ȃ����ꂽ��������邽�߁C���ӂ�v����Ƃ���ł���B
�@�����ɂ����ẮC���҂�h�i�[����̌���������@�Ȃ�тɐ����ɂ����鐶���R�������12�j�C��`�q�g�݊������i�̏ꍇ�̓J���^�w�i�@13�j�̑�Ȃǂɒ��ӂ��C�������邢�͏��F�\���Ɍ��������i�̐����H���ƕi���K�i���m������B�܂��C�Đ���Ó����i���̋@�\�����\���鐶��������I�肵�C���̊ȈՃA�b�Z�C�n���\�z���āCPotency
Assay�Ƃ��邱�Ƃ����i�Ԃ̋ψꐫ��]�����邤���ł��d�v�ł���B���Ɋԗt�n���זE�ł�FGF2�Ȃǂ̃o���N���C�����q��G�N�\�\�[����Potency
Assay�ɉ��p���鎎�݂�����B
3.3 �@�K��
�@�@ �Đ���Ó����i�Ɋ֘A���鍑���O�̖@�K���𗝉����C���炷�邽�߂̐헪�𗧂Ă�B
�@�A ���F�\���̃v���Z�X��c�����C���F�\�������ɕK�v�ȃf�[�^�����W����B���ɁC���ۋ��������⍑�O�ł̏��F�̔���ڎw���ۂɂ͑O�����Ċe���̋K�����E�c���̏�C������}���Ă������Ƃ��K�v�ł���B
�@�Đ���ẤC�ᕪ�q���i��o�C�I���i�ƈقȂ�C�������זE���`�q��p���邽�߁C�h�i�[����̌�������C���̐����E�i���Ǘ��E���S���]���ɂ����Ċe�����L�̗ϗ��E�@�I�ۑ肪���݂���B�Đ���Âɑ���@�K���͊e���ɂ��قȂ邪�C�Đ���ÂɊւ���Z�p��i�����E�I�ɍL����ɏ]���C�W�@�K�̍��ۉ��Ɛ����Z�p�̕W�����̗���ɂ���i�\4�j�B�����������ەW���������ƌv��Ɏ�����C���i�J����i�߂邱�Ƃ́C�Đ���Ð��i�̍��ۓI�ȕi���ƈ��S�����m�ۂ��C���i�̍��ێs��ւ̑��������Ƌ����͊m�ۂ̂��߂ɕs���ł���B

�Q�l����
1�j�Đ���Ó��̈��S���̊m�ۓ��Ɋւ���@���CAvailable
at�F
https://elaws.e-gov.go.jp/document?lawid=425AC0000000085
�iAccessed�F 4 October 2024�j
2�j���i�C��Ë@�퓙�̕i���C�L�����y�ш��S���̊m�ۓ��Ɋւ���@���CAvailable at�F
https://elaws.e-gov.go.jp/document?lawid=335AC0000000145
�iAccessed�F 4 October 2024�j
3�j�������i�H�i�q�������� �Đ��E�זE��Ð��i���CAvailable at�F
https://www.nihs.go.jp/cbtp/home/index.html �iAccessed�F
4 October 2024�j
4�j�����J���ȃz�[���y�[�W�u�Đ���Âɂ��āv�CAvailable at�F https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/iryou/saisei_iryou/index.html
�iAccessed�F 4 October 2024�j
5�j���t�{�C�����E�T�[�r�X�O���[�v �������w�Y�Ɖ� �i2023�j �Đ���ÁE��`�q���Â̎Y�Ɖ��Ɍ�������ՋZ�p�J�����ƒ��ԕ]���^�I�����]��
�⑫���������C Available at�F https://www.meti.go.jp/shingikai/sankoshin/sangyo_gijutsu/kenkyu_innovation/hyoka_wg/pdf/066_h01_00.pdf
�iAccessed�F 4 October 2024�j
6�jAMED �i2017�j �q�g�ٔՊ��זE�̎����ɐ��E�ŏ��߂Đ����|���B��ÁE�Đ���Âւ̍v�������ҁCAvailable
at�F https://www.amed.go.jp/news/release_20171215.html
�iAccessed�F 4 October 2024�j
7�j�����m �i2010�j �����R���̊ԗt�n���זE�ɂ��g�D�Đ��C �������Î��C 31�C pp.
155-163�CAvailable at�F https://www.jstage.jst.go.jp/article/jeajournal/31/3/31_155/_pdf
�iAccessed�F 4 October 2024�j
8�j��ː��� �i2021�j iPS�זE�R������CAR-T/TCR-T��`�q�זE���Ð��܂̍쐻�Z�p���CAvailable
at�F https://www.otsuka.co.jp/company/newsreleases/assets/pdf/20211216_1_01.pdf
�iAccessed�F 4 October 2024�j
9�j���{�Đ���Êw��C�G�N�\�\�[���Ȃǂ̒����E���ÂɊւ���l����
10�j�����J���� �i2017�j �w�q�g���זE��p����Տ������Ɋւ���w�j�C Available
at�F https://www.mhlw.go.jp/file/06-Seisakujouhou-10800000-Iseikyoku/0000150646.pdf
�iAccessed�F 14 October 2024�j
11�j�Đ���Ó����i�̐����Ǘ��y�ѕi���Ǘ��̊�Ɋւ���ȗ߁CAvailable at�F https://elaws.e-gov.go.jp/document?lawid=426M60000100093
�iAccessed�F 4 October 2024�j
12�j����������CAvailable at�F https://www.pmda.go.jp/files/000223393.pdf
�iAccessed�F 4 October 2024�j
13�j�Ɨ��s���@�l���i��Ë@�푍���@�\�iPMDA�j �J���^�w�i�@�ɑ���\���CAvailable
at�F https://www.pmda.go.jp/review-services/drug-reviews/cartagena-act/0003.html
�iAccessed�F 4 October 2024�j
|