|
�P�D�͂��߂�
�@���p�ݔ��ł͌��������h�~�̂��߂ɁC��K�{�ł���B���̐��]���́C�Ȋw�I�ȍ����ɂ��ƂÂ��u�w�I�E�Ő��w�I�]���v�ɂ��Ƃ���C���A�v���[�`��PIC/S
GMP �ɂ����Ă��̗p����Ă���B�����ł́C��w�̍��ې�����}��ϓ_����C����GMP �ȗ߂ɂ����āu�Ő��w�I�]���ɂ��A�v���[�`�v�����Ă���C�����̍���̐��o���f�[�V�����ł́C�Ȋw�I�ȍ����ɂ��ƂÂ����]���C��p���̔��f���K�v�ƂȂ��Ă���B
�@�{�e�ł́C�Ȋw�I�Ȑ��o���f�[�V�����Ɋւ��闬��C���������h�~�v���Ɛ�p���v���Ɋւ���PIC/S
GMP �̓��e�C����GMP �ȗ߂̓��e�C���ƒc�̂���̊֘A�K�C�h���C���C�����āC����̐��o���f�[�V�����̋�̓I�ȗ�����������B�Ȃ��C����GMP
�ȗ߂̐��]���Ɋ֘A���鎖����PIC/S GMP �ɂ���Ă���̂ŁC������PIC/S GMP
����n�߂�̂�������₷���ƍl���C��L�̂悤�ȗ���Ƃ��Ă���B
�@�Ő��w�I�]���ɂ����o���f�[�V�����̏ڍׂɊւ��ẮC�������Q�l�ɂ��Ăق���1�j�B
�Q�D�Ȋw�I�ȍ����ɂ��ƂÂ����o���f�[�V�����̗���
�@���o���f�[�V��������ѐ��]�����Ȋw�I�ɐi�߂悤�Ƃ�������́CISPE
Risk-MaPP �K�C�h���C���ɂ��i2010 �N�j����n�܂��Ă���B���K�C�h���C���́C���]���̂��߂̉Ȋw�I�Ȏw�W�Ƃ��āC�Ő��w�I�Ȏ����i���������j���瓾����f�[�^����їՏ��������瓾����f�[�^�����Ƃɐݒ肳��錒�N�x�[�X���I���E�l�iHealth-Based
Exposure Limit : HBEL�j�������B���̌�CEMA ���K�����ǂƂ��ď��߂āC
����EU-GMP ���o���ɂ����āC���o���f�[�V�����ɉȊw�I�Ȏw�W�����邱�Ƃm�ɂ����i2014
�N�j�B���̌�C�������̈�Ƃ��āCHBEL �ݒ�K�C�h���C������ѕt������Q&A
�̔��o�������Ă���B
�@PIC/S �́C����EU-GMP �����o���ꂽ���N��2015 �N�ɂ́CPIC/S GMP
PE-009 Annex 15 ���o���f�[�V�����̒��ŁC����͓Ő��w�I�ȕ]���ɂ��ƂÂ��Đ��o���f�[�V������i�߂Ă����Ƃ����錾���������̂́C�����͂܂�GMP
�{�́CHBEL �ݒ�K�C�h���C���Ȃǂ̐������\���ł͂Ȃ������B
�@PIC/S �́C���̌�C��̎��ԓI�Ȓx��͂��������̂́CEMA ���t�H���[���Ă��Ă���CGMP
�{�́CHBEL�ݒ�K�C�h���C���C���K�C�h���C����Q&A�C���@�������̌��������h�~�[�u�Ɋւ�����Y�^�CHBEL
�]��������QRM �ɂ����闘�p�Ɋւ�����Y�^�ȂǁC�֘A�K�C�h���C�����e�퐮�����Ă��Ă���B
�@���̂悤�ȗ���̒��ŁCPIC/S �Ƃ̐�����}�낤�Ƃ��āCGMP �ȗ߂̌������������i�߂�ꂽ�B
�R�D�֘A����PIC/S �K�C�h���C��
3.1�@�S�̊T�v
�@����GMP �ȗ߂́CPIC/S �Ƃ̍��ې�����}��Ƃ����ϓ_���甭�o����Ă���B���̓��e���������O�ɁCPIC/S
�̊֘A���镶�����Љ��B����܂��Ă����ƁC����GMP �ȗ߁C�{�s�ʒm�CGMP ����W�i2022
�N�j�̈Ӑ}���Ă���Ƃ��낪�������₷���Ǝv���邽�߂ł���B
�@2024 �N5 �������_�ł́C�֘A����PIC/S �����͈ȉ��̂Ƃ���ł���i�a�����͕M�҂ɂ��j�B
�@�EPIC/S GMP PE 009-17�i2023�N8���j
�@�EPIC/S HBEL�ݒ�K�C�h���C��PI046-1
�@�@�i2018�N7���j
�@�EPIC/S HBEL�ݒ�K�C�h���C��Q&A PI053-1
�@�@�i2020�N6���j
�@�E PIC/S ���@���p�K�C�h�u���p�ݔ��ł̌��������h�~�Ɋւ�����Y�^�vPI043-1�i2018�N7���j
�@�E PIC/S ���@���p�K�C�h�uHBEL�]��������QRM�ɂ����闘�p�Ɋւ�����Y�^�vPI052-1�i2020�N6���j
3.2�@ �Ȋw�I�ȍ����ɂ��ƂÂ����o���f�[�V�����̕�����
�@�Ő��w�I�Ȑ��]�����s���K�v���́CPIC/S-GMP
Annex 15 Qualification & Validation 10.6�ɋL����Ă���i���ӑ��������M�ҁj�B
�u10.6�@���i�c��̎����z���̌��x�l�́C�Ő��w�I�ȕ]���ɂ��ƂÂ��ׂ��ł���B�I�肳�ꂽ���x�l�ɑ��錟�́C���X�N�]���ɂ����ĕ���������Ă���ׂ��ł���C���ׂĂ̍����������܂ށB���܂��g�p����ꍇ�ł��C���̏����ɂ��Ă̌��x�l���m������Ă���ׂ��ł���B�E�E�E�v
�@��1�̕��͂ł́C���]���̂��߂̌��x�l�͓Ő��w�I�]���ɂ��Ƃ��Ă���B��2�̕��͂ł́CHBEL�ݒ�]����������������K�v�����C��3�̕��͂ł́C���܂ɂ��Ă����x�l��ݒ肷��K�v�����q�ׂĂ���B�����āC�Ő��w�I�Ȑ��]���̂��߂̋�̓I�ȃc�[���Ƃ���HBEL�ݒ�K�C�h���C�����r���ɂĈ��p���Ă���B
3.3�@���������h�~�ɑ����{�I�ȍl��
�@PIC/S GMP ��3�� �����G���A3.6�̑O�������ɁC���������h�~�ɑ����{�I�ȍl�����L����Ă���i���ӑ��������M�ҁj�B
�u3.6�@�����ݔ��̓K�Ȑv�Ɖ^�]�ɂ��C���ׂĂ̐��i�ɑ��āC�����������h�~�����ׂ��ł���B����������h�~�������́C���X�N�ɑ����������̂Ƃ��ׂ��ł���B�i�����X�N�}�l�W�����g�̌����ɂ��C���X�N��]�����C�Ǘ����ׂ��ł���B���X�N�̃��x���ɉ����āC�����̈��i�ɂ���Ă����炳��郊�X�N���Ǘ����邽�߂ɁC�����H������т܂��͕�H���̂��߂̌�������ы@��ނ��p������K�v������ꍇ������B�E�E�E�E�E�E�v
�@����������h�~���邽�߂ɂ́C�����Ƃ��i�����X�N�}�l�W�����g�̈�Ƃ��āC���i�i���ɗ^���郊�X�N����肵�C�]�����s���C���̌��ʂɂ��ƂÂ��ċZ�p�I����щ^�p�Ǘ��I�ȑ[�u���Ƃ�̂����߂���B���������h�~�̂��߂̋�̓I�ȕ���
�i�Z�p�I����щ^�p�Ǘ��I�[�u�j��Chapter 5 Production�ɗᎦ����Ă���B
3.4�@��p���v��
�@PIC/S GMP ��3�� �����G���A 3.6�̌㔼�����ɁC��p���v�����L����Ă���i���ӑ��������M�ҁj�B
�u3.6�E�E�E�E
���i�����̂悤�ȃ��X�N�������ꍇ�ɂ́C��p�����ꂽ�����ݔ����K�v�ł���B
�@�ia�j ���X�N���C�^�]����с^�܂��͋Z�p�I�ȕ���œK�ɃR���g���[���ł��Ȃ��ꍇ�B
�@�ib�j �Ő��w�I�ȕ]���ɗR������Ȋw�I�ȃf�[�^���C���X�N���R���g���[���\�ł��邱�Ƃ������Ȃ��ꍇ�i���Ƃ��C�����N�^���̂悤�ȍ����쐫��������Ȃ�A�����M�[���̂��镨���j
�@�ic�j �Ő��w�I�ȕ]�����瓾����K�Ȏc����E���C�o���f�C�g���ꂽ���͕��@�ɂ���āC�����̂����悤�ɓ��肵���Ȃ��ꍇ�B�v
�@��p���v���̊�{�I�Ȍ����́C���������̃��X�N���R���g���[���ł��Ȃ��ꍇ�ɂ͐�p������Ƃ������̂ł���ia�j�B�R���g���[���ł��Ȃ������̗�Ƃ��āC�����N�^���n�R�������̂悤�Ȋ��쐫�̂��镨�����������Ă���ib�j�B�����āC�c����E�i���臒l�j�����͋@��ɂ���āC�\�������̂����悤�ɓ���ł��Ȃ����߂ɃR���g���[���\�łȂ��ꍇ�ɂ͐�p������ic�j�B
�@���́ic�j�ɂ���c����E�����߂�ۂ̃c�[����HBEL�ł���B����HBEL�����Ƃɂ��ē�������臒l�́C���҂̈��S���m�ۂ�����̂ƂȂ�B
���臒l�̌v�Z�����̂́CPIC/S�K�C�h���C���ł͎�����Ă��Ȃ��B�]����0.1�����^�ʊ�̌v�Z���ɂ����āC0.1�����^�ʂɑウ��HBEL���Z�����ē�����i��qISPE�����ASTM����̊e��K�C�h���C�����Q�Ƃ��Ăق����j�B
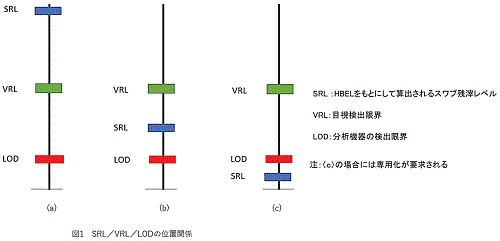
�@���̂悤�Ȍv�Z���œ�������臒l���CISPE Risk-MaPP�K�C�h���C���ł́C�X���u�c�惌�x���iSwab
Residue Level : SRL�j�Ə̂��Ă���i�X���u�T���v�����O�̏ꍇ�j�B
�@����SRL�́C���ʖʐςȂǂ̊e��p�����[�^����уn�U�[�h���x���i���Ȃ킿HBEL���l�j�̑g�ݍ��킹�ɂ��C���l�����Ⴗ��B���臒l�iSRL�j�C�ڎ����o���E�iVisible
Residue Limit : VRL�j�C���͋@��̌��o���E�iLOD�j�Ƃ̑��Έʒu�W�͐}1�̂悤�ɂȂ�B
�@�n�U�[�h���x�������ΓI�ɒႢ�ꍇ�ɂ́C�}1�ia�j�ɂ���悤�ɁCSRL��VRL��LOD�ƂȂ�B�n�U�[�h���x�������ΓI�ɍ����ꍇ�ɂ͐}1�ib�j�̂悤�ɁCVRL��SRL��LOD�ƂȂ�B���臒l���v�Z����ۂ̊e��p�����[�^�̑g�ݍ��킹�ŁCSRL�����͋@��̌��o���x�iLOD�j�ȉ��ɂȂ�ꍇ�͂��蓾��iVRL��LOD��SRL�j�B���̏ꍇ��}1�ic�j�Ɏ����B���̂悤�ȏꍇ�ł́C�c��̃��x�����ǂ̒��x�Ȃ̂������j�^�����O�ł��Ȃ��ɂȂ�̂ŁC�R���g���[���ł��Ȃ��B���̂��߂ɁC��p���v���̌����ɂ��C��p������ƂȂ�B
�@��p������ۂɂ��C���̃��x���͂��܂��܂ł���B���i���p������C�@����p������C�H�������p������C�ݔ����̂��p������ȂNJe��̕����蓾��B���X�N�̃��x���ɉ����đI������B
�S�D����̐��o���f�[�V�����̕�����
�@�����ɂ����鍡��̐��o���f�[�V�����̕������́C�{�s�ʒm�i�Ė���0428��2���u���i�y�ш�O�i�̐����Ǘ��y�ѕi���Ǘ��̊�Ɋւ���ȗ߂̈ꕔ�����ɂ��āv�j�́u��4
�o���f�[�V�����w�j�v�i5�j�o���f�[�V�����̎�ޓ��ɂ����� �B ���o���f�[�V�����̍��ŁC���̂悤�ɋK�肳��Ă���i���������M�ҁj�B
�u�E�E�E���i���̐����c�����̌��x�l�ɂ��ẮC���̐����ݔ��̍ގ��C���Y�����̖w�I�E�Ő��w�I�]�����̉Ȋw�I�ȍ����Ɋ�Â��ݒ肪���߂���B�E�E�E�v
�@����́CPIC/S-GMP Annex 15�̐��o���f�[�V����10.6���Ɠ����ł���B�����c���Ȃǂ̌��x�l�́C�u�w�I�E�Ő��w�I�]�����̉Ȋw�I�ȍ����Ɋ�Â��v�Ƃ��Ă���B����ɂ��CHBEL��p����u�Ő��w�I�]���ɂ����o���f�[�V�����v�̕������������ł����m�ɂȂ����Ƃ�����B
�T�D����GMP�ȗ߂ɂ�������������h�~
�@�ȉ��̎{�s�ʒm�̕\�L�ɂ����ẮC�{�s�ʒm�ł́u�E�E�E���邱�Ɓv�Ƃ����\�L�ɑウ�āC�u�E�E�E����v�Ƃ��C�킩��₷�����Ă���B
5.1�@����GMP�ȗ�
�@����GMP�ȗ߂ɂ�������������h�~�Ɋւ���K��ł����8����2�i���������̖h�~�j�́C�Ɨ�����`�ŐV�݂��ꂽ���̂ł���i���������M�ҁj�B�������Ȃ���C�L�q���e�͋ɂ߂ĒZ���C����̓I�ɂ͎{�s�ʒm�C����ɂ�GMP����W�i2022�N�j�ɂ�炴��Ȃ��B
�u��8����2�i���������̖h�~�j
�����Ǝғ��́C���i�ɌW�鐻�i������������h�~���邽�߁C�����菇���ɂ��ď��v�̑[�u���Ƃ�Ȃ���Ȃ�Ȃ��B�v
5.2�@�{�s�ʒm
�@�{�s�ʒm�ɂ�������������h�~�W�́C���L�̒ʂ�ł���i���������M�ҁj�B
�u��8����2�i���������̖h�~�j�W
�i1�j���i�ɌW�鐻�i�̌���������h�~���邽�߁C�����菇���ɂ��ď��v�̑[�u���Ƃ�Ȃ���Ȃ�Ȃ��B���Y�[�u���Ƃ�ɓ������Ă��CGMP�ȗߑ�3����4��1���̋K��ɂ��i�����X�N�}�l�W�����g�̊��p��v����B
�i2�j���i�ɌW�鐻�i�ւ����������̖h�~�ɂ́C�������̍\���ݔ��ɌW��GMP�ȗߑ�9���C��23���y�ё�26���C�����Ǘ��ɌW�铯�ߑ�10���C��24���y�ё�27�̏��炪�s���ł���B�v
�@��L�̏ȗ߂���ю{�s�ʒm�ɏo�Ă���u����������h�~���邽�߂̏��v�̑[�u�v�ɂ��ẮC��p���v���ɂ��Ă̎{�s�ʒm��9���1����5���W�ɂ��鎟�̋L�q���Q�Ƃ���K�v������i���������M�ҁj�B���̋K�肪��p���v���Ɋ֘A���鍀�ɂ���̂ŁC���X��₱�����B
�u��9���1����5���W
�@�E�E�E
�G�D ����������h�~����K�ȑ[�u�Ɋւ��ẮC���Ɍf������e�ł��邱�Ƃ����߂���
�B
�@�@ �w�I�E�Ő��w�I�]���ɂ��Ȋw�I�f�[�^�Ɋ�Â��āC���Y���i���̐����̎c���Ǘ����\�ł���|�����t�����邱�ƁB�܂��C���Y�����̎c���Ǘ��̂��߂̌��x�l�ɂ��āC�w�I�E�Ő��w�I�]���Ɋ�Â��Đݒ肳��C�����ꂽ���͖@�ɂ��K�ɒ�ʂ��邱�Ƃ��ł��邱�ƁB
�@�A ��L �@ �܂��C���Y�����̕s�������͐����ݔ��̐��i���j�ɂ��āCGMP�ȗߑ�13���ɋK�肷��o���f�[�V�������K�ɍs���邱�ƁB
�@�B ���̑����Y��Ǝ��ɂ�������i�ɌW�鐻�i�ւ����������̖h�~�Ɋւ��āC�i�����X�N�}�l�W�����g�����p���Đ��i�̐����Ǘ��y�ѕi���Ǘ��i��L
�A �̕s�������͐����s��ꂽ��̍ĉ�����h�~����K�v�ȑ[�u���܂ށj���s���邱�ƁB
�@�@�@�E�E�E�v
�@��L�� �@ �ł́C����̋@��\�ʂɂ���c��̊Ǘ����\�ł���̂����߂Ă���B���̍ۂ̃c�[�����C�w�I�E�Ő��w�I�]���ɂ��Ȋw�I�f�[�^�ł���C��̓I�ɂ�HBEL���Y������B
�@�����āC�c��ʊǗ��̂��߂̐��臒l���C�w�I�E�Ő��w�I�]���ɂ��ƂÂ��āi���Ȃ킿�CHBEL�ɂ��ƂÂ��āj�ݒ肳��C�����ꂽ���͖@�ɂ��K�ɒ�ʂł���i���Ȃ킿�C���͋@��̌��o���E����Œ�ʓI�ɓ���ł���j�̂��K�v�Ƃ���Ă���B
�@�A �ł́C����������h�~����K�ȑ[�u�Ƃ��āC��K�ɍs����̂����߂Ă���B����́C���ɓ��R�Ǝv����B
�@�B �ł́C�i�����X�N�}�l�W�����g�����p���Đ��i�̐����Ǘ�����ѕi���Ǘ����s���̂����߂Ă���B������C��ɐ�������PIC/S�K�C�h���C���̓��e�Ɠ����ł���B
�Q�l����
1�j����ȁC�Ő��w�I�]���ɂ����o���f�[�V������2��
�` PIC/S�K�C�h �E ����GMP�ȗߓ��܂���HBEL�ɂ��ƂÂ����]�� �`�C���ق��C�i2022�N�j�C321�y�[�W
|