|
1.はじめに
実験ノートやワークシートは,言うまでもなく実験や測定の実施内容が記録されたものである。また,データファイルとは実験や測定結果など,得られた一連のデータの集合体を綴じたもののことである。したがって,実験ノート・ワークシート及びデータファイルの内容は生データそのものである。
以下では生データの定義についてまず述べ,続いて実験ノート・ワークシート及びデータファイルの取扱いについて紹介する。
2.生データの定義
生データの代表的な定義としては,「最初にとらえた情報(オリジナルデータ)」が一般的であると思われる。しかし定義にこだわることはそれほど重要ではなく,定義よりも生データの実例を知ることの方が重要である。GMP事例集(2022年版)1)には「生データ」にはどのようなものが該当するかの事例を示している。以下はその引用である(太字で示した)。
生データは,最終結果が正しく出されたことを検証することができるものであることが必要である。例えば,試験検査に係る生データとしては,次のものが挙げられる。
1.測定機器からプリント機能により出力されるデータ
2.記録計から出力されるチャート又は読み取った値を記録したもの
3.測定機器に表示される値を書き取ったもの
4.観察結果を書きとめたもの
5.チャートなどの波形データを電子的に記録したファイル
6.写真
7. 上記のデータを使用し計算,換算等を行った際の過程を記録したもの等
なお,データインテグリティの観点から「生データ」は得られた時の状態で利用可能であるよう保存すること。
また,上記以外に次のものも生データとしている施設も多いであろう。
・ 試験用試料や標準品の名称,ロット番号,量,入手日などに関する記録,使用記録,保存記録,廃棄記録など
・ 機器の使用記録,点検記録,校正記録,保守管理記録など
・設備の管理記録など
・教育訓練記録
・覚え書きメモ
・口述筆記
なお,上記で注意しなければならないことは,「覚え書きメモ」を清書した文書は生データとはいえないということである。最初にとらえた情報が生データである。
ところで,前出のGMP事例集(2022年版)の事例の最後には「データインテグリティの観点から」とあるが,データインテグリティは生データと密接な関係がある。
データインテグリティの要件としてよく知られているALCOA(アルコア)2,3)を図1に示したが,
ALCOAと生データの関係は次のようになる。まず,帰属性(A)であるが,これは署名と日付である。紙の生データでは,印刷物に署名またはサインと日付を入れることで生データとなる。電子データではそれらは自動的に記録されることも多いであろうし,電子署名することもありうるが,いずれにせよ署名/サインと日付が特定できるようになっていることが必要である。次に,判読性
(L) は記録としては当然必要なことであるし,同時記録性 (C) と原本性 (O) は生データの定義そのものともいえる。正確性
(A) も記録として当然必要なことである。

3.実験ノート・ワークシートの取扱い
実験ノートもワークシートも実験記録である点では同じである。ワークシートを綴じたものが実験ノートに相当するので,ここでは代表としてワークシートについて紹介する。以下に紙のワークシートの取扱いの注意点を書くが,これは電子ノートなどの電子データでもその本質においては共通点が多い。ただし電子データでは監査証跡が機能していれば,意識せずともそれらの注意点は守られていることが少なくない。
3.1 サイン及び日付,承認
上記でも触れたが,実験内容を記録したワークシートにサインしてはじめて生データとなる。サインがなければ生データとはいえない。サインと同時に日付を書くことも重要である。多くの場合,サインと日付はセットで,一体のものと考えるべきである。なお,日付の書式は施設で統一しておいた方が便利である。たとえば2024年10月22日であれば,2024.10.22
と書く。もちろん 2024/10/22 でもかまわないが,統一することによって後からの第三者チェックの効率が上がるものである。
なお,サインは担当者だけでなく,承認者のサインも必要である。承認者は多くの場合,試験責任者
(SD)である。
3.2 筆記用具
筆記用具は容易に消えたり消したりできないものを使う。通常は黒色または青色の油性ボールペンを使う。当たり前であるが,フリクションボールペンのような消せるボールペンを使ってはいけない。こういったことは標準操作手順書
(SOP) で定めておくとよい。なおちょっとした工夫ではあるが,記録は黒色で書くことが多いであろうから,SDのサインは青色にすると便利である。これは生データをコピー
(モノクロ) したとき,原本と複写物の区別が容易になるからである。生データが大量になる場合,原本とコピーを区別するのは意外とストレスである。
3.3 ワークシートの設計
ワークシートは試験計画書に沿って記録しやすいように設計する。また,第三者が見ても分かりやすいように作成する。しかし,そのような設計の良いワークシートは一朝一夕にはできない。継続的な改善が必要である。図2にはワークシートの型式例を示したが,試験番号や表題,使用機器や試薬,作業内容,署名欄などから成り,このうち最下段の試験責任者の署名欄は承認者としての署名欄である。なお,記録の中心は「作業内容」の欄である。この例では簡略化しているが,使用する試料や検体の記載も重要である。そこにはロット番号や使用期限なども記録する(重要な試薬なども同様)。

3.4 空欄処理
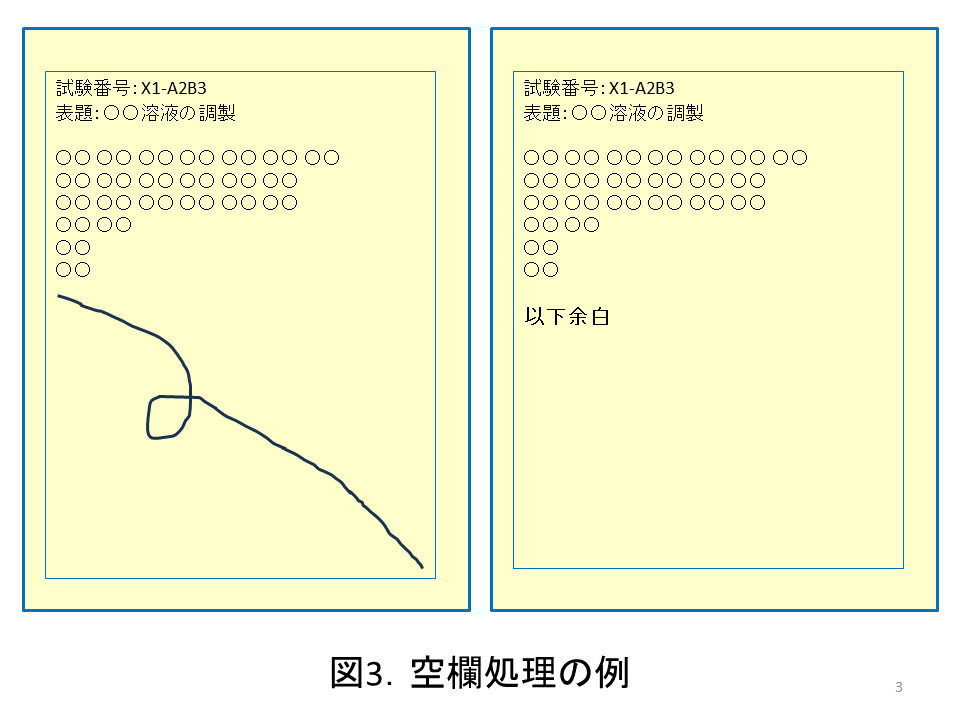
ワークシートでも実験ノートでも,空欄処理が重要である。空欄が残っていると,後日そこに追記されるリスクが残るからである。図3に空欄処理の例を2つ示した。空欄に斜線を引いたり,空欄の最初に「以下余白」と記載することによって後から空欄に書き込めないようにしている。
3.5 生データの訂正・追記方法
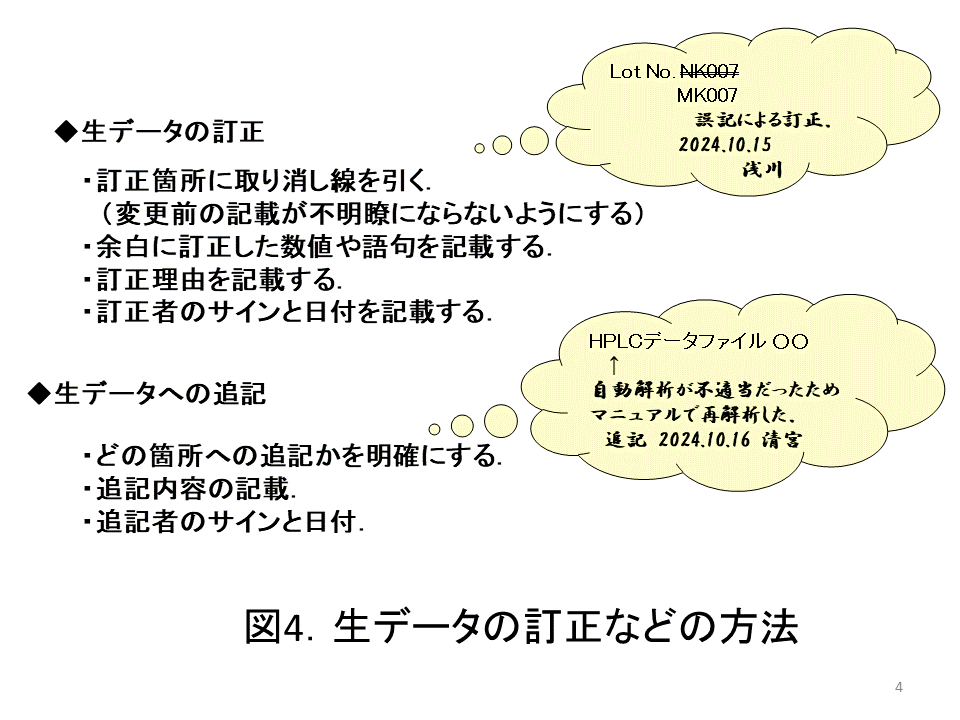
ワークシートなどの記録はときには記載内容を訂正することが発生する。大部分は些細な誤記訂正のことが多い。そのときの訂正の方法を図4に示した(追記方法も示した)。訂正箇所に取り消し線を引くが,重要なことは訂正前と訂正後の記載が明瞭に分かるようにすることである。すなわち,何をどう訂正したかが分かるようすることが重要である。黒塗りして訂正前がどうであったか分からないようではいけない。また,訂正理由とサイン・日付も記録する。これらのことはワークシートに限らず,生データすべてに共通することである。
図4の例では,ロット番号が誤記であったものを訂正した。このような訂正は,試験担当者が実務ですぐに直面する可能性が高いので,新入社員や転入者には真っ先に教育する必要がある。図4には生データへの追記方法も示したが訂正方法とほぼ同じである。
参考文献
1)GMP事例集(2022年版),厚生労働省医薬・生活衛生局
監視指導・麻薬対策課,(令和4年4月28日),151-152
2)Food and Drug Administration, Guidance for Industry
- COMPUTERIZED SYSTEMS USED IN CLINICAL TRIALS.
(1999-04)
https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/fda-bioresearch-monitoring-information/guidance-industry-computerized-systems-used-clinical-trials
3)Food and Drug Administration, Data Integrity
and Compliance With Drug CGMP Questions and Answers
Guidance for Industry. (2018-04)
chrome-extension://efaidnbmnnnibpcajpcglclefindmkaj/https://www.fda.gov/media/119267/download
|